
����Ŀ���������ڽ�����ʵ�ķ���ʽ��д����ȷ����
A.0.1mol/L��ˮ��pHԼΪ11.1��NH3��H2O![]() NH4��+OH��
NH4��+OH��
B.������ [KAl(SO4)2��12H2O]����ˮ����Al3++3H2O![]() Al(OH)3(����)+3H+
Al(OH)3(����)+3H+
C.�ñ���Na2CO3��Һ����ˮ���е�CaSO4(��)��Ca2++CO32��=CaCO3��
D.��K2Cr2O7��Һ�еμ�����ŨH2SO4����Һ��ɫ���![]() (��ɫ)+H2O
(��ɫ)+H2O![]() 2CrO42��(��ɫ)+2H+
2CrO42��(��ɫ)+2H+
���𰸡�C
��������
A����NH3��H2O��ǿ�0.1mol��L��1��ˮ��pHӦΪ13����pHԼΪ11.1����NH3��H2O��������ֵ��룬���뷽��ʽΪNH3��H2O![]()
![]() +OH-��A��ȷ����ѡ��
+OH-��A��ȷ����ѡ��
B�������ܹ���ˮ������������ˮ��Һ�е��������Al3��ˮ�������Al(OH)3���壬�ܹ�����ˮ�е����ʴӶ���ˮ�����ӷ���ʽΪAl3++3H2O![]() Al(OH)3(����)+3H+��B��ȷ����ѡ��
Al(OH)3(����)+3H+��B��ȷ����ѡ��
C���ñ���Na2CO3��Һ����ˮ���е�CaSO4�������ó�����ת������CaSO4ת��Ϊ�����ܵ�CaCO3�����ӷ���ʽΪCaSO4(s)+![]() (aq)=CaCO3(s)��
(aq)=CaCO3(s)��![]() (aq)��C���������⣻
(aq)��C���������⣻
D����K2Cr2O7��Һ�д���ƽ��![]() (��ɫ)��H2O
(��ɫ)��H2O![]() 2
2![]() (��ɫ)+2H+������Ũ�����ƽ�������ƶ���
(��ɫ)+2H+������Ũ�����ƽ�������ƶ���![]() Ũ������ɫ���D��ȷ����ѡ��
Ũ������ɫ���D��ȷ����ѡ��
��ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽��Ũ�ȶ�2Fe3+ + 2I-2Fe2+ + I2 ��Ӱ�죬��������ʵ�飺
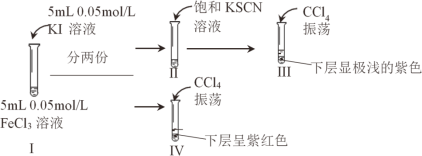
����˵������ȷ����
A.���м���� SCN-���Fe3+ʹƽ�������ƶ�
B.����� I2
C.�Ƚ�ˮ��Һ�е� c(I-)��II>��
D.�Ƚ�ˮ��Һ�е� c(Fe3+)����>I
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӫ��ƽ�������彡����
��1��Ӫ���������������彡���������һ�ִ���ϲ����ʳ�ģ����е����ʡ�ά����A��ά����C����ά�ء����������Ǻͷḻ������п���Ƶ�Ԫ�أ����У�

������������У����������ǡ�___��
�ڵ�������������ˮ������ղ���Ϊ___��
������ȱ��ij����Ԫ�ػᷢ��ƶѪ��������Ԫ����___��
������ˮ����ά���ص���___��ȱ����ά���ػ�����___��
��2����ͼΪijƷ�ƽ��ͱ�ǩ��һ���֡�

�ٰ�����̬���ĺ����ǽ�����������Ҫָ�꣬��Щ���������ɴ��е���ҪӪ������___ˮ�������
�������嵥�����ڷ���������___��
��С���е���ҪӪ��������___��
��3���˽�һЩ��ҩ��ʶ�����������ұ�������������ҩ�̼��þ����ù�ء���˾ƥ�֡�����������
���������ڽ�����ʹ��ҩ����___��
����ù��������___��
��ҩƬ���õ�����Ϊ�ϼ�������ˮ�����ղ�����___��
��ijθҩ����Ҫ�ɷ���AlaMgb(OH)cCO3��������ұ��θ����࣬д������θ�ᷴӦ�Ļ�ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ��̽��Cl2��NO2��NaOH��Һ�еķ�Ӧ����ͨ���ʵ�������Cl2��NO2����������ӦCl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O��
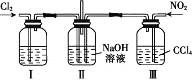
����������ȷ����
A. ʵ�������ö���������3 mol��L-1�����Ṳ���Ʊ�����
B. װ�â���ʢ�ŵ��Լ���Ũ���ᣬ�����Ǹ�������
C. װ�â�������DZ��ڿ���ͨ��NO2����
D. ���Ʊ���NO2�к���NO��Ӧ���������ͨ��ˮ���Գ�ȥNO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ˮ��Һ��1 mol ![]() ������(kJ)��Դ�С����ͼ��ʾ�������й�˵����������
������(kJ)��Դ�С����ͼ��ʾ�������й�˵����������
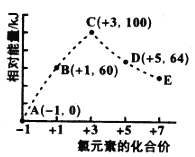
A. ���������н��![]() ������ǿ����E
������ǿ����E
B. �������������ȶ�����A
C. ����������![]() �����Ư���Ե���B
�����Ư���Ե���B
D. ![]() ��Ӧ��ļ���֮��С��������ļ���֮��
��Ӧ��ļ���֮��С��������ļ���֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ�����ͼ��ʾ����������������ǣ�

A. ������ˮ�ķ�����Ҫ�������������������ӽ�����
B. ��NaClΪԭ�Ͽ��������ռ��������ơ�����������Ȼ�����Ʒ
C. ������й����ȿ��������壬����Ϊ���������ܶȱȿ������ܶ�С
D. ��SO2ˮ��Һ����Br2�����ӷ�Ӧ����ʽΪ��Br2+SO2+2H2O�T4H++SO42��+2Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ���أ�K2Cr2O7)�Ǹ��л�ѧ����������������ҵ���Ը�����Ϊԭ���ü����������Ʊ�����������ͨ������Cr2O3��FeO��Al2O3��SiO2�ȡ�
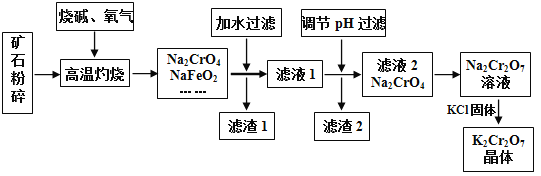
��֪����NaFeO2��ˮǿ��ˮ����2CrO42-(��ɫ) + 2H+![]() Cr2O72-(��ɫ)+H2O
Cr2O72-(��ɫ)+H2O
��ش��������⣺
(1)����ʯ�����Ŀ����________����������ʱCr2O3������Ӧ�Ļ�ѧ����ʽΪ__________��
(2)����1���к��ɫ���ʣ�д�����ɸ����ʷ�Ӧ�����ӷ���ʽ________������2����Ҫ�ɷ���A1(OH)3��______________��
(3)�ü�Ҫ������˵��Na2Cr2O7��Һ�м���KC1���壬��������K2Cr2O7��ԭ��_______��
(4)25��Cʱ���Է�Ӧ2CrO42-(��ɫ)+2H+![]() Cr2O72- (��ɫ)+H2O��ȡNa2CrO4��Һ����ʵ�飬��ò���ʵ���������£�
Cr2O72- (��ɫ)+H2O��ȡNa2CrO4��Һ����ʵ�飬��ò���ʵ���������£�
ʱ��/ (S) | 0 | 0.01 | 0.02 | 003 | 0.04 |
(CrO42-)/ (mol��L-1) | 0.20 | 1.6��10-2 | 1.2��10-2 | 1.0��10-2 | |
(Cr2O72-)/ (mol��L-1) | 0 | 9.2��l0-2 | 9.4��10-2 | 9.5��10-2 |
��Ӧ�ﵽƽ��ʱ����Һ��pH=l���÷�Ӧƽ�ⳣ��KΪ______��
�������й�˵����ȷ��_____________��
a.������NaHCO3���壬��ʹ��Һ�ij�ɫ����
b.0.03 sʱv(CrO42-)(��)=2v(Cr2O72-)(��)
c.��Һ��c(CrO42-):c(Cr2O72-)=2 : 1ʱ�÷�Ӧ����ƽ��״̬
d.��Ӧ�ﵽƽ��ʱCrO42-��ת����Ϊ95%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ����ú����ˮ����Na2S2O35H2O��ʵ���ҿ�������װ�ã���ȥ���ּӳ�������ģ�����ɹ��̡�
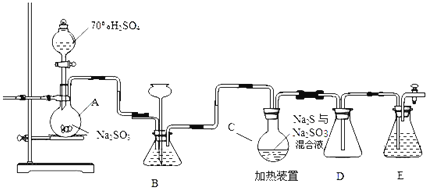
��ƿC�з�����Ӧ���£�
Na2S��aq��+H2O��l��+SO2��g��=Na2SO3��aq��+H2S��aq������ ����
2H2S��aq��+SO2��g��=3S��s��+2H2O��l�������������������� ����
S��s��+Na2SO3��aq��![]() Na2S2O3��aq������������������ ����
Na2S2O3��aq������������������ ����
��1��װ��A�з����Ļ�ѧ��Ӧ����ʽΪ ______
��2��Ϊ��߲�Ʒ���ȣ�Ӧʹ��ƿC��Na2S��Na2SO3ǡ����ȫ��Ӧ������ƿC��Na2S��Na2SO3���ʵ���֮��Ϊ ______ ��
��3��װ��B������֮һ�ǹ۲�SO2���������ʣ����е�Һ�����ѡ�� ______
a������ˮ����b������Na2SO3��Һ����c������NaHSO3��Һ�� d������NaHCO3��Һ
ʵ���У�ΪʹSO2����������ƿC�����õIJ����� ______ ��
��4����֪��Ӧ������Խ���������ƿC�з�Ӧ�ﵽ�յ�������� ______ ��װ��E������Ϊ ______
��5����Ӧ��ֹ����ƿC�е���Һ������Ũ����������Na2S2O35H2O�����п��ܺ���Na2SO3��Na2SO4�����ʣ����������Լ����ʵ�飬����Ʒ���Ƿ����Na2SO4����Ҫ˵��ʵ�����������ͽ��ۣ� ______ ��
��֪��Na2S2O35H2O�����ֽ⣺S2O32+2H+=S��+SO2��+H2O����ѡ����Լ���ϡ���ᡢϡ���ᡢϡ���ᡢBaCl2��Һ��AgNO3��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��S2C12�ǹ㷺������ҵ�����������£�S2C12��һ�ֳȻ�ɫ��Һ�壬��ˮ��ˮ�⣬��������ʹƷ����ɫ�����塣S2Cl2�Ľṹ��H2O2���ƣ�����ͼ��ʾ������˵����ȷ����
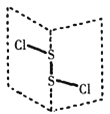
A. S2C12�����е�����Sԭ�Ӿ���sp�ӻ�
B. S2Br2 �� S2C12 �ṹ���ƣ��ۡ��е㣺S2Br2<S2C12
C. S2C12�Ǻ��м��Լ��ͷǼ��Լ��ļ��Է���
D. S2C12 �� H2O ��Ӧ�Ļ�ѧ����ʽΪ2S2C12 +2H2O=SO2��+3S��+4HC1������Ӧ��ת��6mol���ӣ�������3mol����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com