
| A. | 1mol任何物质都含有约6.02×1023个分子 | |
| B. | 0.012kg12C中含有约6.02×1023个碳原子 | |
| C. | 1molH2O2中含有约1mol H2和1molO2 | |
| D. | 阿伏加德罗常数没有单位 |
分析 A.有些物质是由阴阳离子或原子构成的;
B.0.012kg碳-12中含有阿伏伽德罗常数个碳原子,约含有6.02×1023个碳原子;
C.双氧水是由H、O元素组成的,双氧水分子是由2个H原子、2个O原子构成的;
D.阿伏伽德罗常数的单位是/mol.
解答 解:A.构成物质的微粒有分子、原子、离子,物质并不都是由分子构成的,1mol任何微粒均含有约6.02×1023个指定的微粒,故A错误;
B.0.012kg碳-12中含有阿伏伽德罗常数个碳原子,约含有6.02×1023个碳原子,故B正确;
C.双氧水是由H、O元素组成的,双氧水分子是由2个H原子、2个O原子构成的,1mol双氧水中含有2molH原子、2molO原子,故C错误;
D.阿伏伽德罗常数的单位是/mol,故D错误;
故选B.
点评 本题考查物质的量有关计算,明确物质构成微粒及阿伏伽德罗常数意义是解本题关键,注意:阿伏伽德罗常数有单位,易错选项是D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

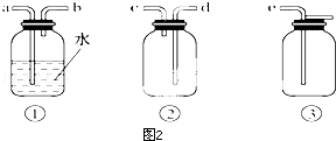

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
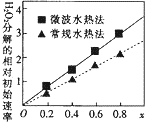 钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水长期放置后会呈现浅黄绿色 | |
| B. | 长期放置的氯水也能使有色布条褪色 | |
| C. | 液氯就是氯气的水溶液,它能使干燥的有色布条褪色 | |
| D. | 用氯气制漂白粉是为了得到易贮存的漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6LO2与5.6LNO混合后的分子总数为0.5NA | |
| B. | 标准状况下,22.4升苯分子中含有6NA个C-Cσ键和6NAC-Hσ键 | |
| C. | 7.8克过氧化钠中含0.2NA阳离子和0.1NA阴离子 | |
| D. | 在500ml0.1mol•L-1NaAlO2溶液中AlO${\;}_{2}^{-}$数为5×10-2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,逆反应速度增大 | |
| B. | 体积不变,充入少量不参加反应的N2,使压强增大,反应速度不变 | |
| C. | 升高温度时,正反应速率增大,逆反应速率减小 | |
| D. | 平衡后加入X,上述反应的△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com