
分析 Cu电极为阴极,发生反应:Cu2++2e-=Cu,阴极质量增重7.04g为析出Cu的质量,粗铜为阳极,由金属性Zn>Cu,故开始发生反应:Zn-2e-=Zn2+,Zn放电完全后,再发生反应:Cu-2e-=Cu2+,溶液质量增重为反应Zn+Cu2+=Cu+Zn2+所致,利用差量法计算Zn的质量,Zn放电时生成Cu的质量,由于Cu放电时,阳极溶解的Cu与阴极析出的Cu相等,故粗铜中Cu的质量=7.04g-Zn放电时生成Cu的质量.
解答 解:Cu电极为阴极,发生反应:Cu2++2e-=Cu,阴极质量增重7.04g为析出Cu的质量,粗铜为阳极,由金属性Zn>Cu,故开始发生反应:Zn-2e-=Zn2+,Zn放电完全后,再发生反应:Cu-2e-=Cu2+,溶液质量增重为反应Zn+Cu2+=Cu+Zn2+所致,
设Zn的质量为m,Zn放电生成Cu为n,则:
Zn+Cu2+=Cu+Zn2+ 溶液质量增重
65 64 65-64=1
m n 0.02g
所以m=$\frac{0.02g×65}{1}$=1.3g
n=$\frac{0.02g×64}{1}$=1.28g
粗铜总质量为(7.04g-1.28g)+1.3g=7.06g
故粗铜中Zn的质量分数为$\frac{1.3g}{7.06g}$×100%=18.4%,
答:粗铜中含锌的质量分数为18.4%.
点评 本题考查电解原理及有关计算,关键是根据离子放电顺序理解溶液增重原因、阴极质量增重不等于粗铜中Cu的质量,属于易错题目,学生容易认为阴极增重质量为粗铜中含有Cu的质量,侧重于学生的分析能力和计算能力的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中,有18个纵行即有18个族 | |
| B. | 最外层电子数为2的元素原子,不一定属于ⅡA族元素 | |
| C. | 在周期表里,元素所在的周期序数等于原子核外的电子层数 | |
| D. | 副族与Ⅷ族元素都是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ③④ | C. | ①② | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

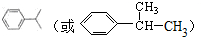 ;
;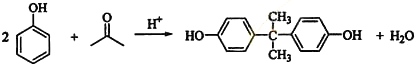 ;
;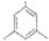 (写出结构简式).
(写出结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3s1和3s23p4 | B. | 3s23p4 和2s22p4 | ||
| C. | 3s2和2s22p5 | D. | 2s22p2 和2s22p4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com