
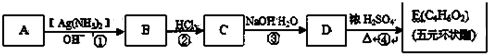
| A. | 乙醇(水):加入新制的生石灰,然后蒸馏 | |
| B. | 乙酸乙酯(乙酸):加入饱和碳酸钠溶液,然后分液 | |
| C. | 乙烷(乙烯):通入酸性高锰酸钾溶液中洗气 | |
| D. | 溴苯(溴):加入氢氧化钠溶液,然后分液 |
分析 A.CaO与水反应后,增大与乙醇的沸点差异;
B.乙酸与碳酸钠反应后,与乙酸乙酯分层;
C.乙烯被氧化生成二氧化碳;
D.溴与NaOH溶液反应后,与溴苯分层.
解答 解:A.CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏可除杂,故A正确;
B.乙酸与碳酸钠反应后,与乙酸乙酯分层,则加饱和碳酸钠、分液可除杂,故B正确;
C.乙烯被氧化生成二氧化碳,引入新杂质,应选溴水、洗气分离除杂,故C错误;
D.溴与NaOH溶液反应后,与溴苯分层,然后分液可除杂,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
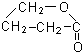 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3-、S2- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | K+、Fe2+、I-、SO42- | D. | Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑧ | B. | ①③⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
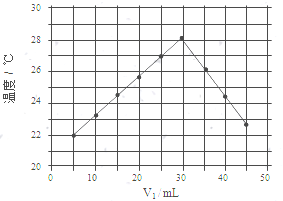
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A. | OA段所发生反应的离子方程式:H++OH-═H2O;CO32-+H+═HCO3- | |
| B. | NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 | |
| C. | 产生的CO2体积(标准状况下)为0.056L | |
| D. | 原NaOH溶液的物质的量浓度为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若形成化学键释放的能量大于断裂化学键所吸收的能量,则是放热反应 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式可表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;.
;.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质:
水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质: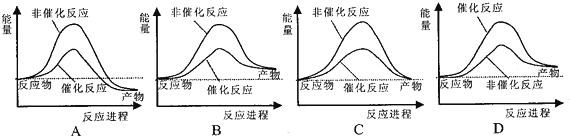
| 物质 | H-H | O=O | H-O |
| 键能/(kJ•mol-1) | 436 | 498 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氧、干冰、硫酸、烧碱、氯化钠 | B. | 碘酒、冰、盐酸、烧碱、食盐 | ||
| C. | 氢气、二氧化硫、硝酸、纯碱、硝酸钾 | D. | 铜、硫酸钠、醋酸、石灰水、氯化铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com