
| A. | 乙二醇 | B. | 乙醇 | C. | 乙醛 | D. | 丙三醇 |
分析 石灰水共增重7.1g,为燃烧生成的二氧化碳与水的质量,10g沉淀为碳酸钙的质量.有机物中的碳全部转化为二氧化碳,有机物中的氢全部转化为水,计算二氧化碳、水的物质的量,进而计算C元素、H元素的质量,根据质量守恒判断有机物中是否含有氧元素,根据原子守恒计算有机物的最简式,结合选项判断.
解答 解:l0g沉淀为CaCO3,物质的量为$\frac{10g}{100g/mol}$=0.1mol,根据碳元素守恒可知,产生的二氧化碳为0.1mol,二氧化碳的质量为0.1mol×44g/mol=4.4g,其中碳元素质量为:0.1mol×12g/mol=1.2g,
石灰水增重7.1g,所以有机物燃烧生成的水的质量为:7.1-4.4=2.7g,物质的量为$\frac{2.7g}{18g/mol}$=0.15mol;氢元素质量为0.3mol×1g/mol=0.3g,
有机样品共3.1g,所以O元素物质的质量=3.1g-1.2g-0.3g=1.6g,氧原子物质的量为:$\frac{1.6g}{16g/mol}$=0.1mol.
即3.1g有机物中n(C)=0.1mol,n(H)=0.15mol×2=0.3mol,n(O)=0.1mol,碳、氢、氧原子的物质的量之比为0.1mol:0.3mol:0.1mol=1:3:1,即最简式为CH3O,只有A选项中乙二醇符合,
故选:A.
点评 本题考查有机物分子式的确定,难度中等,根据质量守恒确定有机物的是否含有氧元素是关键,考查学生的解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 分离汽油和氯化钾溶液的混合液,采用分液的方法 | |
| B. | 除去NaCl溶液中混有的I2,用酒精把NaCl溶液中的I2萃取出来 | |
| C. | 除去02中混有的水蒸气,通过盛有浓硫酸的洗气瓶洗气 | |
| D. | 除去固体碘中混有的少量 Nal.采用加热升华的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n(Na+):n(Cl-)可能为7:3 | |
| B. | 与NaOH反应的氯气一定为0.3mol | |
| C. | 当转移电子为n mol时,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为6:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅是将太阳能转变为电能的常用材料 | |
| B. | 制作航天服的聚酯纤维是新型无机非金属材料 | |
| C. | 为了防止食品受潮变质,常在食品包装袋中放入活性铁粉 | |
| D. | 碱性锌锰干电池属于二次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与少量Al2(SO4)3溶液反应的离子方程式为Al3++40H-═AlO2-+2H2O | |
| B. | 该溶液中滴入酚酞变红,是因NH3•H2O?NH4++0H- | |
| C. | 该溶液中Na+、NH4+、NO3-、Mg2+可大量共存 | |
| D. | 与少量CuSO4溶液反应的离子方程式:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
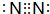 .
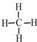
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选 项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使酸性高锰酸钾褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 浓硫酸有强氧化性 | 浓硫酸可使纸张变黑 |
| D | ClO2具有强氧化性 | ClO2可用于自来水的杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com