
(2分)在KCl、ZnCl2、ZnSO4三种盐配成的混合溶液中,已知K+为0.1mol、Zn2+为0.25mol,Cl-为0.2mol,则SO42-为 mol.
科目:高中化学 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从表格中判断以下说法中不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++ SO42-
D.水对于这四种酸的强弱没有区分能力,但在醋酸中可以区别这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:填空题
(12分)低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)该反应逆反应的化学平衡常数表达式为K = 。
(2)上述正反应方向是 反应(填“放热”或“吸热”)。
(3)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)= mol·L-1·min-1。

(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
①表中3 min~4 min之间反应处于 状态;C1数值 0.08 mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是 (单选),表中5 min~6 min之间数值发生变化,可能的原因是 (单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为: 。
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:选择题
把0.6molX气体和0.4molY气体混合2L于容器中使它们发生如下反应:3X(g)+Y(g)  nZ(g)+2W(g),5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·Lˉ1·minˉ1,则上述反应中Z气体的化学化学计量数n是:
nZ(g)+2W(g),5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·Lˉ1·minˉ1,则上述反应中Z气体的化学化学计量数n是:
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:实验题
(14分).海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:
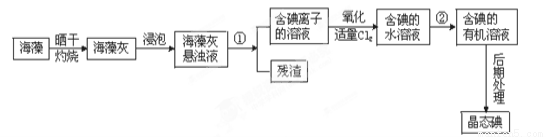
(1)海藻灼烧时是将带其放入 (填仪器名称)中,用酒精灯充分加热灰化。
(2)指出提取碘的过程中有关的实验操作名称:
① ② 、 。
(3)用CCl4从碘水中提取碘经过操作②后,有机溶剂在 (填“上”或“下”)层,有机层呈 色。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,
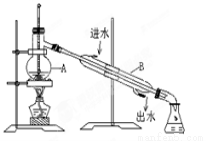
指出上图实验装置中的错误之处并改正:
①
②
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
某溶液中Cl-、Br-、I-三者物质的量之比是1∶2∶3,通入一定量的C12,当反应完后比值为3∶2∶1,则反应的Cl2和原溶液中I-的物质的量之比是
A.1∶2 B.1∶3 C.1∶4 D.1∶6
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
已知最外层电子数相等的元素原子具有相似的化学性质。氧元素原子的核外电子分层排布示意图为

下列原子中,与氧元素原子的化学性质相似的是
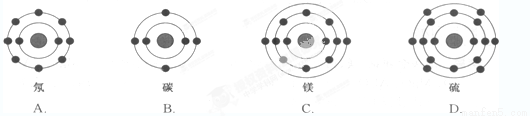
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
在恒容条件下,能使NO2(g)+CO(g)? ?CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增加的措施是
?CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增加的措施是
A.增大NO2或CO的浓度
B.减小CO2或NO的浓度
C.通入Ne使气体的压强增大
D.升高反应的温度
查看答案和解析>>
科目:高中化学 来源:2014秋河北省高二上学期期中化学试卷(解析版) 题型:选择题
CO(g)+H2O(g) H2(g)+CO2(g)ΔH﹤0,在其他条件不变的情况下
H2(g)+CO2(g)ΔH﹤0,在其他条件不变的情况下
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com