
分析 碳酸镁存在溶解平衡:MgCO3?Mg2++CO32-,溶液中镁离子、碳酸根离子的物质的量浓度越大,则溶解的碳酸镁越少,据此进行判断.
解答 解:碳酸镁存在溶解平衡:MgCO3?Mg2++CO32-,溶液中镁离子、碳酸根离子浓度越大,溶解的碳酸镁越少,
①20mL0.1mol•L-1Na2CO3溶液中c(CO32-)=0.1mol/L,
②20mL0.2mol•L-1MgCl2溶液中c(Mg2+)=0.2mol/L,
所以碳酸镁在①中溶解的多,
故答案为:①.
点评 本题考查了难溶电解质的溶解平衡及其影响,题目难度中等,明确难溶物溶解平衡的影响因素为解答关键,试题侧重考查学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
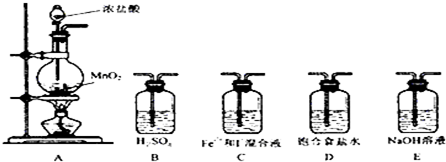
| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加KSCN; 向B试管中滴加淀粉: | ①若A变红色, B不变色则假设1成立 ②若A不变色, B变蓝色则假设2成立 ③若A变红色, B变蓝色则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
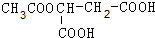 +H2O.
+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含40.0gNaOH的稀溶液与醋酸完全中和,放出57.3kJ的热量 | |
| C. | CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)的燃烧热的热方程式为2CO(g)+O2(g)=2CO2(g)△H=-283.0kJ/mol | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H=akJ/mol,2C(s)+O2(g)=2CO(g)△H=bkJ/mol,则b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
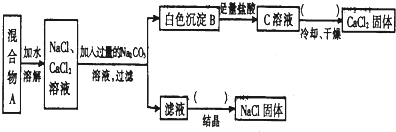
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com