
【题目】实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如下图所示。请回答下列问题:
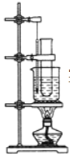
(1)反应需在55~60 ℃的温度下进行,图中给反应物加热的方法是________,
(2)在配制混合酸时先加_____________后加_____________;
(3)该反应的化学方程式是_____________________; 反应类型为:_______;
(4)反应完毕后,除去混合酸,所得粗产品用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④用10% NaOH溶液洗 ⑤水洗 正确的操作顺序是________。
A.①②③④⑤ B.②④⑤③①
C.④②③①⑤ D.②④①⑤③
【答案】水浴加热 浓硝酸 浓H2SO4 ![]() 取代反应 B
取代反应 B
【解析】
苯与浓硫酸、浓硝酸的混合物在55~60℃的温度下发生取代反应生成硝基苯和水,产品精制,应先水洗,溶解混有的酸,再加入碱中和,然后水洗、干燥,最后蒸馏。
(1)苯与浓硫酸、浓硝酸的混合物在55~60℃的温度下发生反应,图中给反应物加热的方法是水溶加热;
(2)配制混合酸时应将密度大的浓硫酸加入到密度小的浓硝酸中去,所以先加浓硝酸后加浓硫酸,并不断振荡,以防止溅出伤人;
(3)苯与浓硝酸在浓硫酸、加热条件下发生取代反应生成硝基苯与水,反应方程式为![]() ,反应类型是取代反应;
,反应类型是取代反应;
(4)产品精制,应先水洗,溶解混有的酸,再加入碱中和,然后水洗、干燥,最后蒸馏,正确的顺序为②④⑤③①,故选B。


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】锡酸钠用于制造陶瓷电容器的基体、颜料和催化剂。工业上以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠的工艺流程图如下,请回答下列问题:

已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
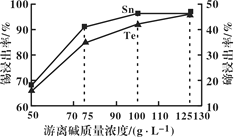
(1)“碱浸”过程中,锡碲浸出率与溶液中游离碱质量浓度关系如图所示,则最理想的质量浓度为__________,理由是______________。
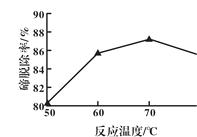
(2)如图反映的是“除碲”过程中反应温度对碲脱除率的影响关系,70℃后随温度升高碲脱除率下降的原因可能是______________。
(3)“除碲”反应的离子方程式为_________________。
(4)从“溶析结晶”回到“碱浸”的物质除烧碱外,主要还有_____________(写化学式)。
(5)“溶析结晶”母液中还含有少量SbO43-,可用锡片将Sb置换出来,锡转化成最高价含氧酸盐,写出反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到如图所示曲线。下列分析错误的是( )
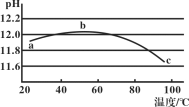
A.b点水解程度最大
B.水的电离平衡也会对溶液的pH产生影响
C.a→b段水解平衡向右移动
D.水解是吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔、乙烯均是重要的化工原料。回答下列问题:
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)═C2H4(g)△H1=-174.3kJ·mol—1
K1(300K)=3.37×1024
C2H2(g)+2H2(g)=C2H6(g)△H2═-311.0kJ·mol一l
K2(300K)═1.19×1042
则反应C2H4(g)+H2(g)═C2H6(g)的△H=___kJ·mol一1,K(300K)=__(保留三位有效数字)。
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。
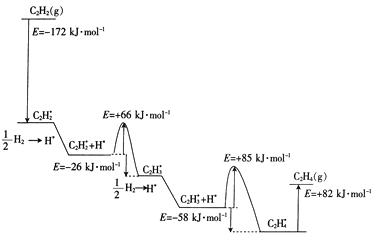
上述吸附反应为____(填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为____kJ·mol-1,该步骤的化学方程式为____。
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g)C2H2(g)+H2(g)。乙烯的离解率为a,平衡时容器内气体总压强为P总,则分压p(C2H4)═___(用p总和a表示)。
(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。
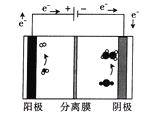
该分离膜为___(填“阳”或“阴”)离子选择性交换膜;生成乙烯的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为__________________。
(2)利用如图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________________处。
②若X为锌,开关K置于M处,该电化学防护法称为__________。
(3)图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量____3.2 g(填“<”“>”或“=”)。
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是______________________,若将开关K置于N处,发生的总反应是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=﹣190kJ/mol。下列说法正确的是
O2(g)=CO2(g)+2H2(g) ΔH=﹣190kJ/mol。下列说法正确的是
A.CH3OH的燃烧热为190kJ/mol
B.该反应说明CH3OH比H2稳定
C.反应中的能量变化与反应体系的温度和压强无关
D.CO2(g)+2H2(g)=CH3OH(g)+![]() O2(g) ΔH=+190kJ/mol
O2(g) ΔH=+190kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在恒温恒容密闭容器中反应,下列条件可判断该反应已经达到平衡状态的是( )
2NO+O2在恒温恒容密闭容器中反应,下列条件可判断该反应已经达到平衡状态的是( )
(1)单位时间内生成nmolO2的同时生成2nmolNO2
(2)单位时间内生成nmolO2的同时,生成2nmolNO
(3)用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的密度不再改变的状态
(6)混合气体的平均相对分子质量不再改变的状态
A.(1)(4)(6)B.(2)(3)(5)
C.(1)(3)(4)D.(1)(2)(3)(4)(5)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图所示装置进行实验,请回答下列问题:

(1)若开始实验时开关K与a连接,则B极的电极反应式为_________。
(2)若开始实验时开关K与b连接,则下列说法正确的是_____(填序号)。
①溶液中Na+向A极移动
②从A极逸出的气体能使湿润的淀粉KI试纸变蓝
③反应一段时间后向电解液中加适量盐酸可使其恢复到电解前的浓度
(3)该小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。

①该电解槽的阳极反应式为_________,通过阴离子交换膜的离子数____(填“>”“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为____;
③电解一段时间后,B口与C口产生气体的质量比为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com