
【题目】下图是某儿童微量元素体检报告单的部分数据:
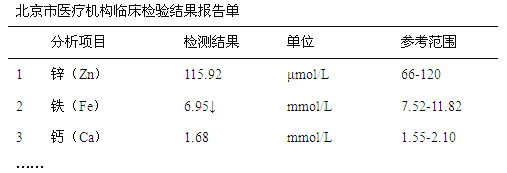
根据上表的数据,回答下列问题:
(1)该儿童__________元素含量偏低。
(2)报告单中“μmol/L”是___________(填“质量”、“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的_________(填“氧化性”或“还原性”)。
(4)缺铁性贫血患者应补充Fe2+。一些补铁剂以硫酸亚铁为主要成分,用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是___________________。
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,则下列结论中正确的是

①铜为负极,锌为正极;②铜极上有气泡;③SO42-向铜极移动;④锌发生还原反应;⑤电子的流向是铜到锌;⑥负极反应式:Zn-2e-=Zn2+
A. ①②B. ①④⑥
C. ②④⑥D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知32gA与40gB恰好完全反应,生成mgC和9gD。在相同条件下,16gA和30gB混合反应生成0.25molC及若干摩尔D,则物质C的摩尔质量应是( )
A.63g/molB.122g/molC.126g/molD.163g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用二氧化锰与浓盐酸反应制取纯净、干燥的氯气,装置如下图所示:
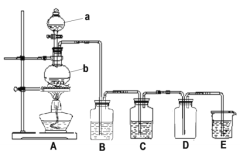
请回答下列问题:
(1)a装置的名称___________________________;
(2)收集氯气的方法为___________________________;
(3)烧瓶中发生反应的化学方程式为______________________;
(4)装置B中饱和食盐水的作用是_____________,装置E的作用是_________________;
(5)取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为6.72L。则参加反应的二氧化锰的质量为______,参加反应的HCl的物质的量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的部分内容。据此下列说法中正确的是( )
硫酸 化学纯CP
500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A.H2SO4的摩尔质量为98g
B.该硫酸的物质的量浓度为9.2mol·L-1
C.配制250mL4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组模拟工业上用SiHCl3与H2在1357 K的条件下制备高纯硅,实验装置如下图所示 (加热及夹持装置略去):(SiHCl3相对分子质量为:135.5)
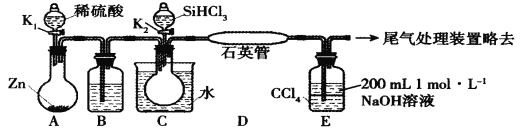
已知SiHCl3的性质如下:沸点为33.0℃;密度为1.34 g·mL-1;易溶于有机溶剂;能与H2O剧烈反应;在空气中易被氧化。请回答:
(1)装置C中的烧瓶用水浴加热的优点为_____________________。
(2)装置D中发生反应的化学方程式为_____________________。
(3)装置E的作用为___________________。
(4)相关实验步骤如下,其合理顺序为_______________ (填序号)。
①加热装置C,打开K2,滴加6.5 mL SiHCl3;
②打开K1,装置A中反应一段时间;
③关闭K1; ④关闭K2; ⑤加热装置D至1357 K。
(5)计算SiHCl3的利用率:对装置E中液体进行分液操作,取上层液体20.00 mL转移至锥形瓶中,滴加几滴酚酞溶液。用0.1 mol·L-1盐酸滴定,达到滴定终点时,消耗盐酸20.00 mL。达到滴定终点的现象是____________。SiHCl3的利用率为__________%(保留两位小数)。
(6)设计实验,检验SiHCl3与水反应后,所得溶液中存在盐酸___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸汽和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80%时放出热量19.6kJ能量,写出该反应的热化学方程式_________ 。
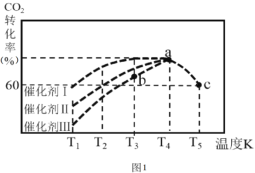
②一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示:催化剂效果最佳的是催化剂______ (填“I、Ⅱ、Ⅲ)。b点v(正) ____v(逆) (填>、< 、=)。此反应在a点时已达平衡状态, a点的转化率比c点高的原因是_______。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=________。(保留两位有效数字) (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
II、汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
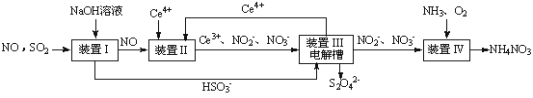
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成NO3-和NO2-物质的量之比为2∶1时的离子方程式:________________________。
(2)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为_________。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1.5 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气__________L(用含a代数式表示,结果保留整数,否则不给分)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
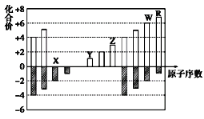
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月4日凌晨,福建泉州泉港区发生“碳九”泄露,对海洋环境造成污染,危害人类健康。“碳九”芳烃主要成分包含![]() (a)、
(a)、![]() (b)、
(b)、![]() (c)等,下列有关三种上述物质说法错误的是
(c)等,下列有关三种上述物质说法错误的是
A. a、b、c互为同分异构体 B. a、b、c均能与酸性高锰酸钾溶液反应
C. a中所有碳原子处于同一平面 D. 1molb最多能与4molH2发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com