
【题目】某温度时,在2L密闭容器中,X、Y、Z 三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析
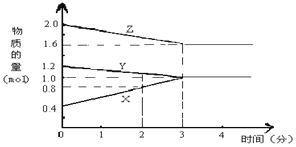
(1)该反应的化学方程式为________。
(2)反应开始至2min末,X的反应速率为_________。
(3)该反应____________。(填序号)
①是可逆反应
②不是可逆反应
【答案】2Z+Y![]() 3X 0.1 mol/(L·min) ①
3X 0.1 mol/(L·min) ①
【解析】
(1)根据图象可知Y、Z浓度降低,为反应物,X浓度增大为生成物,当物质的量不再变化时,达到平衡状态,此时△n(Y)=1.2mol-1.0mol=0.2mol,△n(Z)=2.0mol-1.6mol=0.4mol,△n(X)=1.0mol-0.4mol=0.6mol,计量数之比等于△n(Y):△n(Z):△n(X)=1:2:3,化学方程式可写为Y+2Z![]() X,故答案为:Y+2Z
X,故答案为:Y+2Z![]() 3X;
3X;
(2)反应开始至2min末,△n(X)=0.8mol-0.4mol=0.4mol,△c(X)=0.4mol/2L=0.2mol/L,化学反应速率为0.2mol/L/2min= 0.1 mol/(L·min),故答案为:0.1 mol/(L·min);
(3)3min后,各物质的物质的量不再发生变化,说明反应达到反应限度,即该反应是可逆反应,故答案为:①。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 氨分子是三角锥形,而甲烷是正四面体形,是因为NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
B. 杂化轨道全部参加形成化学键
C. PCl5分子中P原子和Cl原子最外层都满足8电子结构
D. 在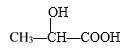 分子中含有2个手性C原子
分子中含有2个手性C原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体相结合的装置示意图如图,当该装置工作时,下列说法正确的是( )
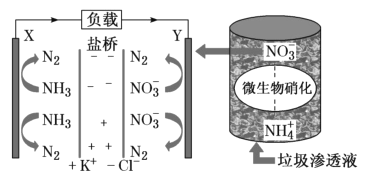
A.盐桥中K+向X极移动
B.电路中流过7.5mol电子时,共产生标准状况下N2的体积为44.8L
C.该装置实现了将电能转化为化学能
D.Y极发生的反应为2NO3--10e-+6H2O=N2↑+12OH-,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。
回答下列问题:
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式__。第三电离能:Ca__Ti(填“大于”或“小于”)。
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是__。
②O3分子的中心原子杂化类型为___;与O3互为等电子体的是__(任意写一种)。
(3)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl![]() 2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dgcm3。

①Na3OCl晶胞中,O位于各顶点位置,Cl位于__位置。
②用a、d表示阿伏加德罗常数的值NA=__(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如图:

下列说法不正确的是( )
A.石灰石、纯碱、石英都属于盐,都能与盐酸反应
B.用铝土矿制备较高纯度Al的过程中常用到NaOH溶液、CO2、冰晶石等
C.在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2:1
D.黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验某溶液中是否含有SO![]() 的方法中正确的是( )
的方法中正确的是( )
A.向该溶液中加入酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO![]()
B.向该溶液中加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
C.向该溶液中加入足量HCl,无现象,再加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
D.向该溶液中加入BaCl2溶液,产生白色沉淀,再加入HCl沉淀不溶解,说明该溶液中一定有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更简便地制取干燥的NH3,下列方法中适合的是
A.NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥
B.N2+3H2![]() 2NH3,用烧碱进行干燥
2NH3,用烧碱进行干燥
C.加热浓氨水,气体用碱石灰干燥
D.加热NH4HCO3,气体用P2O5干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室常用的几种气体发生装置如图A、B、C所示。
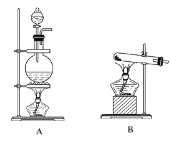
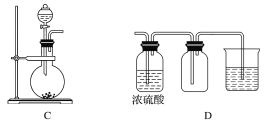
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的试剂是_________;
检查C装置的气密性是否良好的操作方法是____________________________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
如图是某学生设计收集气体的几种装置,其中不可行的是________。
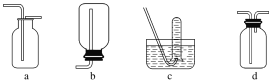
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2
II.镁与稀硝酸的反应为:Mg+HNO3(稀)——Mg(NO3)2+NO↑+H2O(未配平)
(4)该反应中,还原产物是_________,HNO3表现了___________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写及评价合理的是( )
选项 | 离子方程式 | 评价 |
A |
| 正确, |
B |
| 正确, |
C | 将少量的 | 正确, |
D | 将 | 错误, |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com