
【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】2017年2月19日在第十三届阿布扎比国际防务展上,采用先进的氢燃料电池系统的无人机,创造了该级别270分钟续航的新世界记录。下列有关氢燃料电池的说法不正确的是
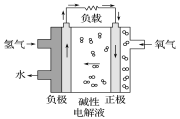
A. 通入氢气的电极发生氧化反应
B. 碱性电解液中阳离子向通入氢气的方向移动
C. 正极的电极反应式为O2+2H2O+4e-===4OH-
D. 放电过程中碱性电解液的OH-的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO、SiO2等氧化物杂质)制取金属锌的流程如图所示。回答下列问题:

(1)ZnFe2O4中Fe的化合价为______价,已知ZnFe2O4能溶于酸,则酸浸时ZnFe2O4反应的离子方程式为_________________________,酸浸后滤渣的成分主要是__________。
(2)酸浸时一般要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可以采用的方法是___________________(任答一条即可)
(3)净化Ⅰ中H2O2参与反应的离子方程式为_________________________________,试剂X的作用是_______________,
(4)净化Ⅱ中得到的Y是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 实验室应将钠保存在煤油中
B. 金属镁失火不可用二氧化碳来灭火
C. 可用酒精代替CCl4萃取碘水中的碘单质
D. 某试样焰色反应呈黄色,则试样中可能含有K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.三氧化硫极易溶于水,能与水反应生成硫酸
B.标准状况下,1mol三氧化硫的体积为22.4L
C.二氧化硫在空气中易被氧化为三氧化硫
D.三氧化硫具有漂白性,能使品红溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱.下列说法不正确的是
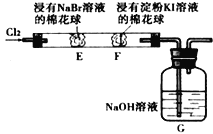
A. E处棉花球变成橙黄色,说明Cl2的氧化性比Br2强
B. F处棉花球变成蓝色,说明Br2的氧化性比I2强
C. E处发生反应的离子方程式为:Cl2 + 2Br- = 2Cl- + Br2
D. G装置中NaOH溶液与Cl2反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是

A. b、c互为同分异构体
B. a、c分子中所有碳原子均有可能处于同一平面上
C. a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D. a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2与漂粉精是常用的漂白剂。某兴趣小组对它们的漂白原理进行探究。过程如下:
I. 探究SO2的漂白性
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中,观察到前者褪色而后者不褪色。
实验二:
| 试管中的液体 | 现象 |
a. 0.1 mol/L SO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
b. 0.1 mol/L NaHS03溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
c. 0.1 mol/L Na2SO3溶液( pH=10) | 溶液立即褪色 | |
d. pH=10NaOH溶液 | 红色溶液不变色 | |
e. pH=2H2SO4溶液 | 红色溶液不变色 |
(1)实验d的目的是____________。
(2)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是____________。
(3)已知S02使品红溶液褪色过程是可逆的。兴趣小组继续试验:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红。
请用离子方程式和必要的文字说明出现上述现象的原因____________。
II. 探究SO2与漂粉精的反应
实验三:
操作 | 现象 |
| i. 液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
小组同学对上述现象进行探究:
(1)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a. 用湿润的碘化钾淀粉试纸检验白雾,无变化;
b. 用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是____________________。
②由实验a、b不能判断白雾中含有HCl,理由是____________。
(2)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是____________。
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀x中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是____________。
②用离子方程式解释现象iii中黄绿色褪去的原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com