
 ,
, ;
;| 1.5g |
| 75g/mol |


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:

| A、气体A能使湿润的红色石蕊试纸变蓝,气体B能使湿润的蓝色石蕊试纸变红 |
| B、白色沉淀甲是混合物,白色沉淀乙是纯净物 |
| C、Ag+、Ba2+、Al3+、MnO4-、SO42-一定都不存在于溶液中 |
| D、Na+、AlO2-、CO32-一定存在于溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2912 kJ |
| B、2953 kJ |
| C、3236 kJ |
| D、3867 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al跟NaOH溶液共热 |
| B、Al(NO3)3跟过量的NaOH溶液 |
| C、A12O3和水共热 |
| D、A12(SO4)3和过量的NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
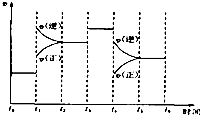 已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.查看答案和解析>>
科目:高中化学 来源: 题型:
 近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产NaOH和H2SO4,下列主产法中不正确的是( )
近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产NaOH和H2SO4,下列主产法中不正确的是( )| A、阴极反应式4OH--4e-=2H2O+O2↑ |
| B、阴极得到NaOH,阳极得到H2SO4 |
| C、每生产1molH2SO4,同时得到2mol NaOH |
| D、此反应实质就是电解水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平均反应速率:v(A)=v(C) |
| B、其它条件不变,升温,气体总的物质的量增加 |
| C、A的平衡浓度为0.4mol/L |
| D、A与B的平衡浓度之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钡的化学式为Ba2O2 |
| B、晶体中阴阳离子个数比为2:1 |
| C、1mol过氧化钡与足量水反应生成0.5mol氧气 |
| D、过氧化钠和过氧化钡都是强氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com