
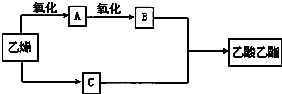
分析 B与C反应生成乙酸乙酯,由信息中乙烯氧化生成乙醛,结合转化关系可知,A为CH3CHO,乙醛进一步氧化生成B为CH3COOH,乙烯与水发生加成反应生成C为CH3CH2OH,据此解答.
解答 解:B与C反应生成乙酸乙酯,由信息中乙烯氧化生成乙醛,结合转化关系可知,A为CH3CHO,乙醛进一步氧化生成B为CH3COOH,乙烯与水发生加成反应生成C为CH3CH2OH.
(1)物质C为CH3CH2OH,俗称酒精,故答案为:酒精;CH3CH2OH;
(2)由A→B的化学方程式为:2CH2=CH2+O2 $→_{加热、加压}^{催化剂}$2CH3CHO,
故答案为:2CH2=CH2+O2 $→_{加热、加压}^{催化剂}$2CH3CHO;
(3)由B+C→乙酸乙酯的化学方程式:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,属于酯化反应或取代反应,
故答案为:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化或取代.
点评 本题考查有机物的推断,比较基础,涉及烯烃、醇、醛、羧酸、酯的性质与转化,注意基础知识的掌握.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
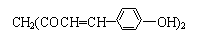 ,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )| A. | 3 mol、5 mol | B. | 6 mol、8 mol | C. | 10 mol、8 mol | D. | 6 mol、10 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素(除了稀有气体元素外),从左到右,原子半径依次减小 | |
| B. | 对于第三周期元素,从钠到氯,原子半径依次减小 | |
| C. | 各元素的原子半径总比其离子半径大 | |
| D. | 阴离子的半径大于其原子半径,阳离子的半径小于其原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
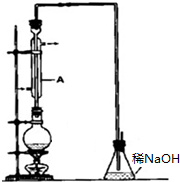 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
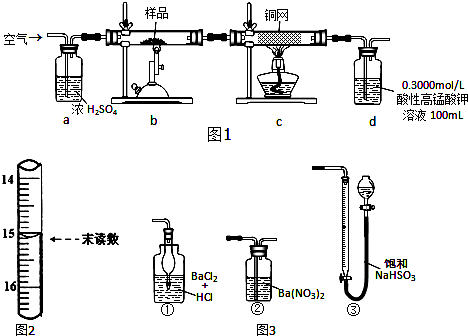
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
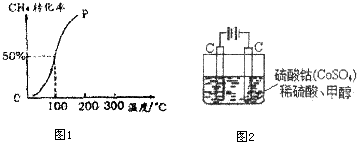
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com