
【题目】下列反应的离子方程式正确的是
A.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C.钠与水的反应:Na+H2O=Na++OH-+H2↑
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂、有机合成中氯化的催化剂等。实验室制备四氯化锡所需的有关装置和信息如下:

有关信息:①将金属锡熔融,通入干燥氯气进行反应,生成四氯化锡;②无水四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃;③四氯化锡易水解。
回答下列问题:
(1)装置甲中反应容器的名称是____________;试剂E和F分别是___________、____________。
(2)装置甲中发生反应的化学方程式为_____________________;
装置戊中发生反应的化学方程式为______________________。
(3)上述各装置的连接顺序是甲→_________→___________→_________(填装置标号),实验开始时点燃的酒精灯是_________(填“甲”或“戊”)。
(4)装置乙的作用是______________________________。
(5)实验所得SnCl4中因溶解了Cl2而略显黄色,提纯SnCl4的方法是__________(填标号)。
a.用NaOH溶液洗涤 b.升华 c.重结晶 d.蒸馏 e.过滤 f.萃取
(6)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性,原因是___________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 聚丙烯能使酸性高锰酸钾溶液褪色
B. 分馏石油得到的各馏分都是纯净物
C. 蛋白质水解和油脂皂化都是高分子转化成小分子的过程
D. C4H10有2种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化工厂为了综合利用生产过程中的副产品CaSO4,和相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:
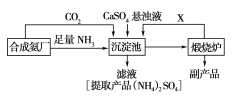
请回答以下问题:
(1)合成氨反应的化学方程式是_____。沉淀池中发生的主要反应方程式是____________。该反应能够发生的原因是______________________。
(2)在上述流程的沉淀池中通入足量氨气的目的是_______________________________________,可以循环使用的X是________。
(3)该生产过程中的副产品是__,从绿色化学和资源综合利用的角度说明上述流程的主要优点是_____;从物质的性质和工业生产实际的角度考虑该流程的主要缺陷是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、社会可持续发展密切相关。下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤推广使用节能环保材料.
A. ①③⑤ B. ②③⑤ C. ①②④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质和用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆
B.CO具有还原性,可用于冶炼铁等金属
C.SiO2熔点高,可用作光导纤维
D.Al2O3具有两性,可用作耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的元素用原子序数表示,其中都属于主族的一组元素是( )
A. 2、4、6 B. 19、20、21 C. 1、3、5 D. 8、16、18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质应用的叙述中,不正确的是( )
A. 氢氧化铝可用于治疗胃酸过多
B. ClO2用于饮用水消毒
C. 水玻璃浸泡过的木材既能防腐又能耐火
D. Si用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2N0+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
设计制备装置如下(夹持装置略去)。
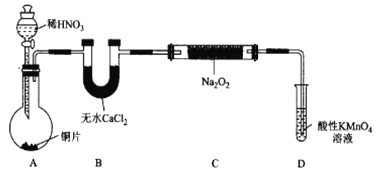
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为_______________。
(2)如果没有B装置,C中发生的副反应有____________。
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。于是在A 与B 装且间增加了___________装置,改进后提高了NaNO2的纯度。
【实脸II】 测定制取的样品中NaNO2的含量
步骤:
A.在5个有编号的带刻度试管(比色管)中分别加人不同址的NaNO2溶液,各加入1 ml的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
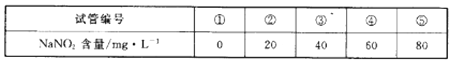
b.称量0.10g制得的样品溶于水配成500 ml溶液。取5mL待测液,加入1mlM溶液,后加蒸馏水至10mL振荡,与标准色阶比较。
(4)步脚b中比较结果:待测液颜色与③号色阶相同。则甲同学制得的样品中NaNO2的质量分数是______%。
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
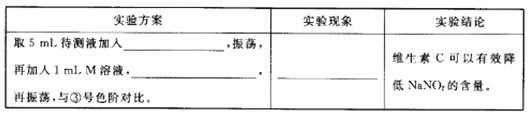
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com