£Ø2013?¼ĆÄĻ¶žÄ££©ĮņŌŖĖŲµÄ»ÆŗĻĪļŌŚÉś²ś”¢Éś»ī֊ӊ׏ć·ŗµÄÓ¦ÓĆ£®
£Ø1£©400”ę£¬1.01”Į10
5PaĻĀ£¬ČŻ»żĪŖ1.0LµÄĆܱÕČŻĘ÷ÖŠ³äČė0.5molSO
2£¬£Øg£©ŗĶ0.3molO
2 £Øg£©£¬·¢Éś2SO
2£Øg£©+O
2£Øg£©?2SO
3£Øg£©”÷H=-198kJ?mol
-1·“Ó¦ÖŠn£ØSO
3£©ŗĶn£ØO
2£©Ėꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĶ¼1ĖłŹ¾£®·“Ó¦µÄĘ½ŗā³£ŹżK=
160
160
£»0µ½10minÄŚÓĆSO
2£ŗ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹ
0.04mol/£ØL?min£©
0.04mol/£ØL?min£©
£®øü¾ßĶ¼1ÖŠŠÅĻ¢£¬ÅŠ¶ĻĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ
AC
AC
£ØĢīŠņŗÅ£©£®
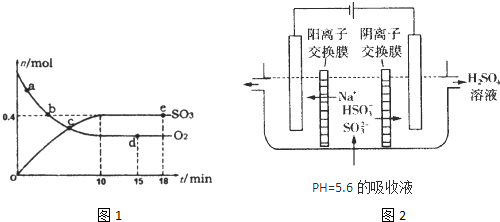
A£®aµćŹ±æĢµÄÕż·“Ó¦ĖŁĀŹ±ČbµćŹ±æĢµÄ“ó
B£®cµćŹ±æĢ·“Ó¦“ļµ½Ę½ŗāדĢ¬
C£®dµćŗĶeµćŹ±æĢµÄc£ØO
2£©ĻąĶ¬
D£®Čō500”ę£¬1.01”Į10
5PaĻĀ£¬·“Ó¦“ļµ½Ę½ŗāŹ±£¬n£Ø SO
3£©±ČĶ¼ÖŠeµćŹ±æĢµÄÖµ“ó
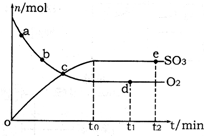
£Ø2£©ÓĆNaOHČÜŅŗĪüŹÕ¹¤Ņµ·ĻĘųÖŠµÄSO
2£¬µ±ĪüŹÕŅŗŹ§Č„ĪüŹÕÄÜĮ¦Ź±£¬25”ꏱ²āµĆČÜŅŗµÄpH=5.6£¬ČÜŅŗÖŠNa
+£¬H
+£¬SHO
3-£¬SO
32-Ąė×ÓµÄÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ
c£ØNa+£©£¾c£ØHSO3-£©£¾c£ØH+£©£¾c£ØSO32-£©
c£ØNa+£©£¾c£ØHSO3-£©£¾c£ØH+£©£¾c£ØSO32-£©
£Ø3£©æÉĶعżµē½ā·ØŹ¹£Ø2£©ÖŠµÄĪüŹÕŅŗŌŁÉś¶ųŃ»·ĄūÓĆ£Øµē¼«¾łĪŖŹÆÄ«µē¼«£©£¬Ę乤×÷Ź¾ŅāĶ¼ČēĶ¼2£ŗ
HSO3-ŌŚŃō¼«ŹŅ·“Ó¦µÄµē¼«·“Ó¦Ź½ĪŖ
HSO3-+H2O-2e-=SO42-+3H+
HSO3-+H2O-2e-=SO42-+3H+
£®Ņõ¼«ŹŅµÄ²śĪļ
H2ӢNaOH
H2ӢNaOH
£®





![]() mY(g)+Z(g)£¬²āµĆĘ½ŗā»ģŗĻĘųĢåÖŠXµÄĢå»ż·ÖŹżĪŖ58.80%£¬»ģŗĻĘųĢåµÄ×ÜÖŹĮæĪŖ46.00 g£¬»ģŗĻĘųĢåµÄĆܶČĪŖ0.72 g”¤L-1£¬ŌņĘ½ŗā»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæĪŖ(””””)
mY(g)+Z(g)£¬²āµĆĘ½ŗā»ģŗĻĘųĢåÖŠXµÄĢå»ż·ÖŹżĪŖ58.80%£¬»ģŗĻĘųĢåµÄ×ÜÖŹĮæĪŖ46.00 g£¬»ģŗĻĘųĢåµÄĆܶČĪŖ0.72 g”¤L-1£¬ŌņĘ½ŗā»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæĪŖ(””””) 2SO3µÄ·“Ó¦£¬²¢ĒŅŌŚ10minŗó“ļµ½Ę½ŗāŹ±£¬²āµĆČŻĘ÷ÄŚÓŠ2molSO2ŗĶ12molO2:
2SO3µÄ·“Ó¦£¬²¢ĒŅŌŚ10minŗó“ļµ½Ę½ŗāŹ±£¬²āµĆČŻĘ÷ÄŚÓŠ2molSO2ŗĶ12molO2: