
【题目】(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是 。
(2)A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断A可能是 ,B可能是 。
(3)在标准状况下,CO和CO2的混合气体质量为36 g,体积为22.4 L,则CO所占的体积是 L,质量是 g。
【答案】(每空2分)
(1)XY3
(2)CO或N2或C2H4 H2
(3)11.2 14
【解析】(1)一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积Z,由气体的体积之比等于物质的量之比,等于化学计量数之比,则X2+3Y2![]() 2Z,由原子守恒可知,Z的化学式为XY3。
2Z,由原子守恒可知,Z的化学式为XY3。
(2)混合物气体的总物质的量为![]() =0.4 mol,又因为A与B的物质的量之比为3∶1,所以A的物质的量为0.3 mol,B的物质的量为0.1 mol,设B的相对分子质量为x,则A的相对分子质量为14x,混合气体的总质量为8.6 g,0.3×14x+0.1x=8.6,得x=2,所以B为H2,A的相对分子质量为28,A可能为CO或N2或C2H4。
=0.4 mol,又因为A与B的物质的量之比为3∶1,所以A的物质的量为0.3 mol,B的物质的量为0.1 mol,设B的相对分子质量为x,则A的相对分子质量为14x,混合气体的总质量为8.6 g,0.3×14x+0.1x=8.6,得x=2,所以B为H2,A的相对分子质量为28,A可能为CO或N2或C2H4。
(3)标准状况下,混合气体的物质的量为![]() =1 mol,令混合气体中CO和CO2的物质的量分别为x、y,则:
=1 mol,令混合气体中CO和CO2的物质的量分别为x、y,则:![]()
解得:x=0.5 mol,y=0.5 mol;
故CO的体积为0.5 mol×22.4 L·mol1=11.2 L,
CO的质量为0.5 mol×28 g·mol1=14 g。


科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是;2Cu2O+ Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1) Cu+的价电子轨道表示式为_______; Cu2O与Cu2S比较,晶格能较大的是_______.
(2)新制的Cu(OH)2能够溶于过量浓碱溶液中,反应的离子方程式为______。
(3) SO2中心原子的价层电子对数目为_______, SO2分子构型为_________。
(4)将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图I所示。此固态SO3中S原子的杂化轨道类型是_______;该结构中S一O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为_________(填图中字母)。


(5)CuFeS2的晶胞如上图Ⅱ所示。CuFeS2的晶胞中与Cu原子距离最近且相等的Fe原子有____个;其晶体密度ρ=______g·cm-3 (列出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖,则有关14C的正确叙述是( )
A. 与12C60的碳原子化学性质不同 B. 与14N含的中子数相同
C. 是12C60的同素异形体 D. 与12C、13C互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 使用“乙醇汽油”、“燃煤固硫”、“汽车尾气催化净化”等可提高空气质量
B. 液氯、明矾净水原理相同
C. 硅胶和铁粉均可用于食品的防腐
D. 陶瓷、水泥和光导纤维均属于硅酸盐材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O5常用作纺织业棉麻脱氯剂;酸化时可放出SO2气体。其制备工艺流程
如下:
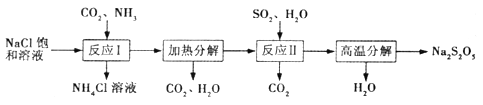
(1)Na2S2O5的名称为_______________(选填“焦硫酸钠”或“焦亚硫酸钠”)。
(2)“反应I ”中应先通入的气体是______,反应后析出的固体产物是____________。
(3)“反应II”的化学方程式为_________________________。
(4)若反应条件或用量等控制不当,则所得的Na2S2O5产品中往往含有杂质。
①若产品中含有杂质Na2SO3,其具体原因可能是______________(任答一条即可);
②若检验产品中含有杂质Na2SO3,下列试剂的使用顺序依次为_________(填编号)。
a.稀硫酸 b.澄淸石灰水 c.品红溶液 d.酸性KMnO4溶液
(5)Na2S2O3也可用作棉麻的脱氯剂。
①Na2S2O5溶液与Cl2反应的离子方程式为____________________;
②Na2S2O5与Na2S2O3脱氯等效时,消耗二者的质量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL 1.5 mol·L1稀硫酸中加入过量Mg粉,充分反应后,滤去多余Mg粉,滤液在t ℃下恒温蒸发,当滤液质量为72.0 g时开始析出MgSO4·xH2O晶体,当析出晶体12.3 g时,剩下滤液48.0 g。通过计算回答下列问题。
(1)计算生成标准状况下的气体体积(请写出计算过程);
(2)开始析出MgSO4·xH2O晶体时溶液的质量分数为 ;
(3)MgSO4·xH2O中的x= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。下列有关麦考酚酸说法正确的是( )

A. 分子式为C17H23O6
B. 不能与FeCl3溶液发生显色反应
C. 在一定条件下可发生加成、取代、消去反应
D. 1 mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用四种基本反应类型的分类方法,分析下列反应各属于哪种类型的反应。
①2H2+O2![]() 2H2O ②CuO+H2
2H2O ②CuO+H2![]() Cu+H2O
Cu+H2O
③NH4HCO3![]() NH3↑+H2O↑+CO2↑ ④2CO+O2
NH3↑+H2O↑+CO2↑ ④2CO+O2![]() 2CO2
2CO2
⑤H2O(g)+C![]() H2+CO ⑥Ba(OH)2+H2SO4===BaSO4↓+2H2O
H2+CO ⑥Ba(OH)2+H2SO4===BaSO4↓+2H2O
(1)化合反应:________。
(2)分解反应:________。
(3)置换反应:________。
(4)复分解反应:________。
(5)氧化还原反应:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com