
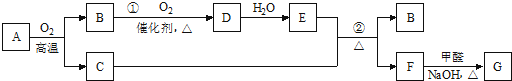
分析 根据题中各物转化关系,F与甲醛反应生成G为砖红色沉淀,则G为Cu2O,用逆向推断可知,F生成G的反应是醛基的检验,所以,F为CuSO4;从B→D→E,可推断为NO→NO2→HNO3或SO2→SO3 →H2SO4等.因为B→D的转化需用催化剂,可判定B为SO2,D为SO3,E为H2SO4,A应为Cu2S,符合A为某金属矿的主要成分,经过一系列反应可得到气体B和固体C的条件,反应②为浓硫酸和铜在加热条件下的反应,反应的化学方程式为Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,根据电解池和原电池原理分析和书写电极反应式,根据反应速率概念计算反应速率,根据影响平衡移动的因素判断平衡移动方向,甲醛与新制氢氧化铜发生氧化还原反应,据此答题.
解答 解:根据题中各物转化关系,F与甲醛反应生成G为砖红色沉淀,则G为Cu2O,用逆向推断可知,F生成G的反应是醛基的检验,所以,F为CuSO4;从B→D→E,可推断为NO→NO2→HNO3或SO2→SO3 →H2SO4等.因为B→D的转化需用催化剂,可判定B为SO2,D为SO3,E为H2SO4,A应为Cu2S,符合A为某金属矿的主要成分,经过一系列反应可得到气体B和固体C的条件,反应②为浓硫酸和铜在加热条件下的反应,反应的化学方程式为Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,根据电解池和原电池原理分析和书写电极反应式,根据反应速率概念计算反应速率,根据影响平衡移动的因素判断平衡移动方向,甲醛与新制氢氧化铜发生氧化还原反应,
(1)根据上面的分析可知,B为SO2,G为Cu2O,
故答案为:SO2;Cu2O;
(2)反应②的化学方程式是 Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)用电解法提纯金属铜的方法是将粗铜作为电解池的阳极,精铜作为电解池的阴极,一般用CuSO4溶液作电解质溶液;MnO2是碱性锌锰电池的正极材料,电池放电时,正极是二氧化锰得到电子,则电极反应式为:MnO2+H2O+e-=MnO(OH)+OH-,
故答案为:CuSO4溶液;粗铜;MnO2+H2O+e-=MnO(OH)+OH-;
(4)在一个固定容积为2L的密闭容器中充入0.20mol的SO2和0.10mol的O2,半分钟后达到平衡,测得容器中含SO3为0.18mol,v(SO3)=$\frac{\frac{0.18mol}{5L}}{0.5min}$=0.072mol/(L•min),速率之比等于化学计量数之比,故v(O2 )=$\frac{1}{2}$v(SO3)=$\frac{1}{2}$×0.072mol/(L•min)=0.036mol/(L•min);
若继续通入0.20mol SO2和0.10mol O2,压强增强,平衡向正反应移动,反应转化率增大,再次达到新平衡后,SO3的物质的量大于0.18mol×2=0.36mol,若0.4molSO2与0.2molO2完全反应,可以生成0.4molSO3,反应物不能完全转化,故达SO3小于0.4mol,即SO3的物质的量介于0.36mol和0.40mol之间;
故答案为:0.036;向正反应方向;0.36;0.4;
(5)F为CuSO4,G为Cu2O,F→G转化过程中,甲醛参与反应的化学方程式为:HCHO+4Cu(OH)2→2Cu2O↓+5H2O+CO2↑,故答案为:HCHO+4Cu(OH)2→2Cu2O↓+5H2O+CO2↑.
点评 本题考查了物质转化关系和物质性质的应用、化学反应速率的计算和平衡移动的判断、电化学原理的应用等,本题考查较为综合,题目难度较大,注意根据物质的特殊颜色推断物质的可能性,用逆推的方法进行推断,把握常见元素化合物的性质.


科目:高中化学 来源: 题型:解答题
 双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题:
双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题: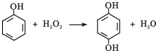 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.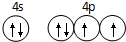 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 表述Ⅰ | 表述Ⅱ |
| A | 浓硝酸在光照下颜色变黄 | 浓硝酸具有不稳定性 |
| B | Cl2和SO2有漂白性 | Cl2和SO2均可使含有酚酞的NaOH溶液褪色 |
| C | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
| D | SiO2有导电性 | SiO2可用于制备光导纤维 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁能与酸反应,可用于制作红色涂料 | |
| B. | 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 | |
| C. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| D. | 维生素C是水溶性维生素,能增强人体抵抗力,有解毒作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的转化率 | B. | 反应体系的压强 | ||
| C. | 正、逆反应的速率 | D. | 反应混合物的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 房屋装修所用装饰材料释放出的甲醛、苯、氨等气体对人体无害,不会造成污染 | |
| B. | 食品包装袋小包内盛有装氧化钙或生石灰用作食品的抗氧化剂 | |
| C. | 制作航天服的聚酯纤维和“天宫一号”中使用的碳纤维都是新型无机非金属材料 | |
| D. | 绿色化学的核心就是利用化学原理从源头减少和消除工业对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的化合物一定属于醇类 | |
| B. | 含有跟链烃基相连的羟基的有机物一定是醇类 | |
| C. | 酚类和醇类具有相同的官能团,因而具有相同的化学性质 | |
| D. | 分子内有苯环和羟基的化合物一定是酚类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、CO2、HCl | B. | H2、Cl2、H2S | C. | NH3、O2、H2 | D. | CO2、H2S、SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com