
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可分为许多种,如燃烧热和中和热等。
(1)10g氢气燃烧生成气态水,放出1209kJ热量,若H2O(1)=H2O(g) △H=+44kJ/mol,写出表示氢气燃烧热的热化学方程式:______。
(2)利用50mL0.25molL-1硫酸、50mL 0.55molL-1NaOH溶液,在如图所示装置中测定中和热,回答下列问题:
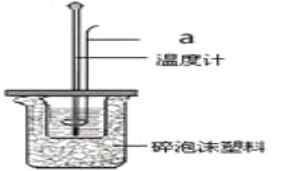
①仪器a的名称是_____。
②使用下列用品不是为了减小实验误差的是______。
A.两个量筒 B.仪器a C.泡沫塑料板 D.碎泡沫塑料
③向装有盐酸的小烧杯中倒入NaOH溶液的正确操作是____。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
④假设硫酸和氢氧化钠溶液的密度都是1gcm-3,又知中和反应后生成溶液的比热容c=4.18Jg-1℃-1,△t=3.4℃,该实验测得的中和热数值为____。(保留一位小数)
⑤下列操作不会使测量的中和热数值改变的是___。
A.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
B.结合日常生活实际该实验在保温杯中进行
C.用 0.275molL-1Ba(OH)2溶液代替氢氧化钠溶液
D.把仪器a改为铜制品
E.用60mL 0.5molL-1盐酸与50mL 0.55molL-1 NaOH溶液反应
F.用0.5molL-1醋酸代替硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池放电时的工作原理如图所示。下列叙述正确的是( )

A. 放电时Li+由B极向A极移动
B. 电池放电反应为4Li+O2+2H2O===4LiOH
C. B电极反应式为O2+4H++4e-===2H2O
D. 电解液a可以为氯化锂溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某硫酸试剂标签上的部分内容。下列说法错误的是( )

A.常温下,该硫酸可以用铁制容器运输
B.敞口放置的该硫酸因挥发而导致浓度变小
C.该硫酸的物质的量浓度为18.4molL﹣1
D.配制250mL0.4molL﹣1的稀硫酸需取该硫酸约5.4mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.28g乙烯和丙烯中的极性键数目为4NA
B.1.0molCH4与Cl2在光照下反应生成CH3Cl分子数为1.0NA
C.1mol氖气中含有的原子总数为2NA
D.0.1L0.1molL-1MgCl2溶液中的Mg2+数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)密闭容器中mA(g)+nB(g)![]() pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图。则:
pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图。则:
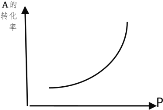
①增大压强,A的转化率___平衡向___移动,达到平衡后,混合物中C的浓度___。
②上述化学方程式中的系数m、n、p的正确关系是____。
③当降低温度时,C的浓度减小,正反应是___热反应。
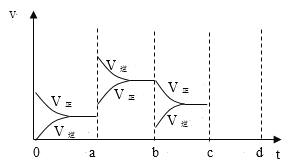
(2)如图表示在密闭容器中反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a-b过程中改变的条件可能是___;b-c过程中改变的条件可能是____;若增大压强时,反应速度变化情况画在c-d处。___
2SO3(g)△H<0,达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a-b过程中改变的条件可能是___;b-c过程中改变的条件可能是____;若增大压强时,反应速度变化情况画在c-d处。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2S(g)+O2(g) = S2(s)+2H2O(l) △H= -632 kJmol-1,如图为质子膜H2S 燃料电池的示意图。下列说法正确的是

A.标准状况下,每 11.2 LH2S 参与反应,有1 mol H+经固体电解质膜进入正极区
B.电池工作时,电子从电极b 经过质子膜流向电极 a
C.电路中每流过 4 mol 电子,电池内部释放632 kJ 的热能
D.电极b 上发生的电极反应式为:O2+4e-+2H2O = 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)中的钒大部分是以V(III)和V(IV)形式存在,由含矾石煤提钒的一种工艺流程如图所示:

已知:铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物。
回答下列问题:
(1)含矾石煤预制时加入复合添加剂对钒浸出率的影响如图所示,其中最佳复合添加剂为__,最佳添加比例为__。

(2)如图为“抽滤”实验原理装置图,"抽滤”时抽气泵的作用是__;“酸浸渣”经“水洗涤”返回“浸出”的目的是__。

(3)已知酸浸液中V2O24+被H2O2氧化成VO2+,其离子方程式为__。“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因是__。
(4)“沉钒”的离子反应方程式为___。
(5)“煅烧”纯净的沉钒产物过程中,固体残留率与温度变化如图所示。已知A点坐标为(260℃,85.47%)。则A点对应物质的化学式为__,B点对应的物质为V2O5,则B点坐标为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。

(1)该反应的化学方程式为_____________,此反应平衡常数的表达式为K=________。
(2)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是________,该反应的△H________0。(填“![]() ”、“
”、“![]() ”或“=”)
”或“=”)
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的关系为_______(用“![]() ”、“
”、“![]() ”或“=”连接)。
”或“=”连接)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com