
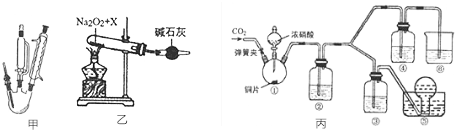
分析 Ⅰ(1)可结合反应物的性质及有机反应的特征来解答;
(2)有机层粗产物中有少量的硫酸,可以用氢氧化钠除去;
(3)通过分液操作除去水层后,硝基苯中混有多余的苯,可结合二者的沸点差异,利用蒸馏分离;
Ⅱ(1)在一定条件下氨气与氧气反应生成一氧化氮和水;
(2)氨催化氧化法制硝酸的原料气是氧气和氨气,其中过氧化钠能与水或CO2反应生成氧气,故X能提供氨气和二氧化碳或水,且X为固体,据此分解推断X的成分;
Ⅲ(1)根据装置特点和实验目的判断;
(2)根据二氧化氮的性质且能转化为一氧化氮选择试剂;
(3)根据对比实验③、④的实验现象判断.
解答 解:Ⅰ(1)制硝基苯的反应物硝酸高温易分解,苯易挥发,有机反应如果反应条件控制不当易产生副反应,故答案为:防止浓硝酸分解和苯的挥发(或生成副产物间二硝基苯);
(2)有机层粗产物中有少量的硫酸和硝酸,可以用氢氧化钠除去产品中的硫酸和硝酸,
故答案为:除去产品中未反应的酸;
(3)分液后的有机层主要成分是硝基苯,另有少量未反应的苯;可根据苯和硝基苯的沸点差异,利用蒸馏分离,故答案为:苯;蒸馏;
Ⅱ:(1)①氨催化氧化的产物是一氧化氮和水,是工业生产硝酸获得一氧化氮的一步反应,化学方程式为4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O;
②利用过氧化钠与水或二氧化碳生成氧气,则X须受热分解生成氨气、二氧化碳和水,故应该为NH4HCO3或(NH4)2CO3,故答案为:NH4HCO3或(NH4)2CO3;
Ⅲ:(1)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2防止污染大气;因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸,
故答案为:3mol/L稀硝酸;浓硝酸;氢氧化钠溶液;
(2)装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2+H2O=2HNO3+NO,故答案为:将NO2转化为NO;
(3)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之.装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体,
故答案为:装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色.
点评 物质制备实验探究,考查了硝酸苯的制备与分离提纯、氨气的实验室制备和实验方案的评价、考查HNO3的性质、属物质验证性实验设计,利用对比的方法判断硝酸的性质.结合已知的物质具有的性质,选择合适的试剂,设计具体实验方案验证物质是否具有该性质.对有毒气体要设计尾气处理装置,防止污染环境.


科目:高中化学 来源: 题型:解答题
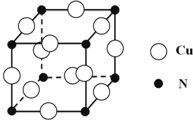 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: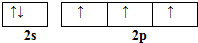 .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.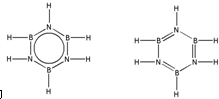 ,.
,.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
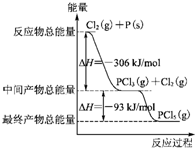 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
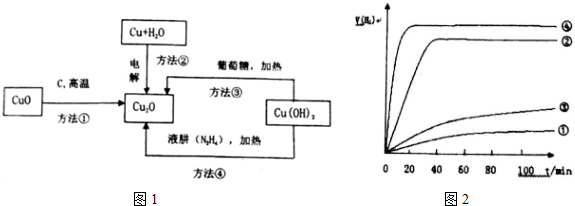
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
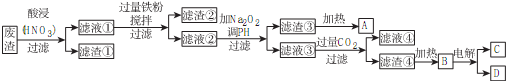
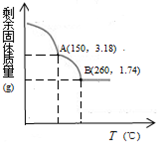 某铜(Ⅱ)盐晶体组成可以表示为Ka[Cub(C2O4)c]•dH2O,其组成可通过下列实验测定:
某铜(Ⅱ)盐晶体组成可以表示为Ka[Cub(C2O4)c]•dH2O,其组成可通过下列实验测定:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
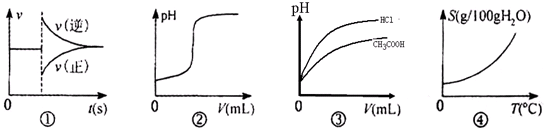
| A. | 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时pH的变化 | |
| C. | 图③可以表示相同pH的醋酸和盐酸溶液分别加水稀释时溶液的pH随体积的变化 | |
| D. | 图④可以表示所有的固体物质溶解度随温度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com