
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
分析 A.pH=1的溶液中存在大量氢离子,碳酸根离子与氢离子反应;
B.c(H+)=1×10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子,镁离子、铜离子与氢氧根离子反应;
C.四种离子之间不反应,都不与碳酸氢铵反应;
D.铁离子与硫氰根离子反应.
解答 解:A.pH=1的溶液呈酸性,溶液中存在大量氢离子,CO32-与氢离子反应,在溶液中不能大量共存,故A错误;
B.c(H+)=1×10-13mol•L-1的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,Mg2+、Cu2+与氢氧根离子反应,在碱性溶液中不能大量共存,故B错误;
C.K+、Na+、NO3-、Cl-之间不发生反应,都不与NH4HCO3反应,在溶液中能够大量共存,故C正确;
D.Fe3+和SCN-之间发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
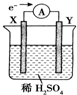 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 溶液中,SO42-朝Y极移动 | |
| B. | 若两电极分别为铁和碳棒,则X为碳棒,Y为铁 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应中KMnO4被氧化 | |
| B. | HCl发生还原反应 | |
| C. | 每消耗2mol HCl时,反应中转移的电子为2 mol | |
| D. | 氧化剂与还原剂的物质的量之比为1﹕5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+H2O HCO3-+OH-; 用热的纯碱溶液清洗油污 | |
| B. | SnCl2+H2OSn( OH)Cl+HCl;配制氯化亚锡溶液时加入氢氧化钠溶液 | |
| C. | A13++3HCO3-=Al (OH)3↓+3CO2↑;泡沫灭火器灭火 | |
| D. | A13++3H2OAl (OH)3(胶体)+3H+;明矾净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 全部 | B. | ①②④⑤⑥ | C. | ②③④⑤⑥ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠和水反应:2Na2O2+2 H2O=4Na++4OH-+O2↑ | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2 OH-=2AlO2-+H2↑ | |
| C. | 氢氧化钡溶液滴入稀硫酸中:Ba2++OH一+H++SO42-=BaSO4↓+H2O | |
| D. | 二氧化碳通入足量氢氧化钠溶液:CO2+OH-=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
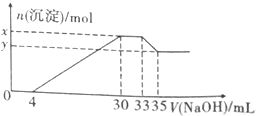 在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | x-y=2×10-3mol | B. | 原溶液的pH=2 | ||
| C. | 原溶液中n(Cu2+)=0.025mol | D. | 原溶液中c(NH4+)=7.5×10-3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 该溶液中含硝酸钾 202 g | |
| B. | 100 mL 该溶液中含硝酸钾 0.02 mol | |
| C. | 从 1 L 该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1 mol/L | |
| D. | 1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
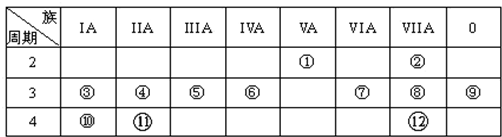
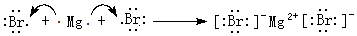 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com