
【题目】现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H.其中B是地壳中含量最多的金属.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出). 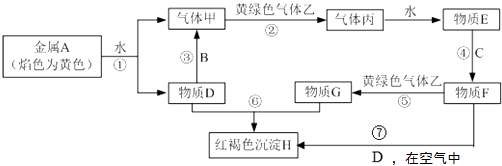
(1)写出化学式:B , G
(2)写出离子反应方程式: ③
⑦ .
【答案】
(1)Al;FeCl3
(2)2Al+2H2O+2OH﹣=2AlO2﹣+3H2↑;4Fe2++8OH﹣+O2+2H2O=4Fe(OH)3
【解析】解:金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2 , H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,考虑Na与水的反应,故甲为H2 , D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3 , G含有Fe3+ , 由E(盐酸) ![]() F
F ![]() G可知,C为Fe,F为FeCl2 , G为FeCl3 , FeCl2与氢氧化钠在空气中生成氢氧化铁,符合各物质的转化关系,(1)根据上面的分析可知,B为Al,G为FeCl3 , 所以答案是:Al;FeCl3;(2)反应③为铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子反应方程式为2Al+2H2O+2OH﹣=2AlO2﹣+3H2↑,反应⑦为FeCl2与氢氧化钠在空气中生成氢氧化铁,反应的离子反应方程式为4Fe2++8OH﹣+O2+2H2O=4Fe(OH)3 , 所以答案是:2Al+2H2O+2OH﹣=2AlO2﹣+3H2↑;4Fe2++8OH﹣+O2+2H2O=4Fe(OH)3;
G可知,C为Fe,F为FeCl2 , G为FeCl3 , FeCl2与氢氧化钠在空气中生成氢氧化铁,符合各物质的转化关系,(1)根据上面的分析可知,B为Al,G为FeCl3 , 所以答案是:Al;FeCl3;(2)反应③为铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子反应方程式为2Al+2H2O+2OH﹣=2AlO2﹣+3H2↑,反应⑦为FeCl2与氢氧化钠在空气中生成氢氧化铁,反应的离子反应方程式为4Fe2++8OH﹣+O2+2H2O=4Fe(OH)3 , 所以答案是:2Al+2H2O+2OH﹣=2AlO2﹣+3H2↑;4Fe2++8OH﹣+O2+2H2O=4Fe(OH)3;


科目:高中化学 来源: 题型:
【题目】有机物M的合成路线如下图所示:
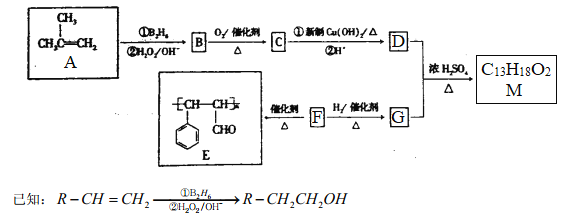
请回答下列问题:
(1)有机物A的系统命名为___________。
(2)F→E的反应类型为_________;B中所含官能团的名称为___________。
(3)M的结构简式为___________。
(4)C与新制Cu(OH)2悬浊液反应的化学方程式为___________。
(5)F有多种同分异构体,其中含苯环且与F所含官能团相同的同分异构体有_____种。
(6)参照M的合成路线,设计一条由丙烯和乙醇为起始原料制备丙酸乙酯的合成路线(无机试剂任选)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为pg .cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的有
①![]() ②
②![]() ③上述溶液中加入VmL水后,所得溶液的质量分数大于0.5ω ④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
③上述溶液中加入VmL水后,所得溶液的质量分数大于0.5ω ④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A. ②③ B. ②④ C. ③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯Zn片和纯Cu片用导线连接置于同一稀H2SO4 溶液中,下列各叙述中正确的是
A.Zn片上有大量气泡产生
B.负极附近c(SO42-),逐渐增大
C.正极、负极附近c(SO42-)基本不变
D.电子经电解质溶液由正极流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.8mol X 气体和0.4mol Y 气体混合于2L 密闭容器中,使它们发生如下反应:2X(g)+Y (g)n Z (g)+2W (g).2min 末已生成0.2mol W,若测知以Z的浓度变化表示的反应速率为0.05mol(Lmin)﹣1 , 计算:
(1)前2min内用X的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度.
(3)化学反应方程式中n 值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条褪色,说明有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。
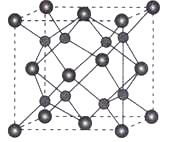
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO 、CO2 、N2O4三种气体分别都含有0.5 mol氧原子,三种气体的物质的量之比为( )
A. 1:1:2 B. 4:2:1 C. 1:1:1 D. 1:2:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com