
【题目】物质A~K有如图的转化关系,其中D、E为气体单质,A、H为常见金属。试回答(图中有些反应的产物和反应的条件没有全部标出):
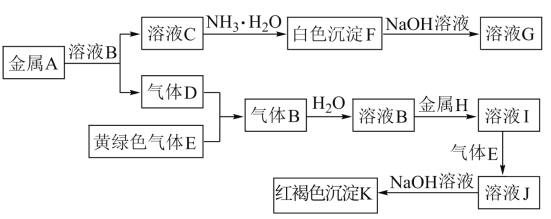
(1)写出下列物质的化学式:D是________, I是______。
(2)写出“C→F”反应的离子方程式:______________________________________。
(3)写出反应“J→K”的离子方程式:____________________________________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是______________________________。
【答案】H2 FeCl2 ![]()
![]() 产生白色沉淀,迅速变成灰绿色最后变成红褐色
产生白色沉淀,迅速变成灰绿色最后变成红褐色
【解析】
黄绿色气体E为Cl2,红褐色沉淀K为Fe(OH)3,金属H与溶液B反应得到I,I能被氯气氧化得到J,J与氢氧化钠反应得Fe(OH)3,可推知H为Fe、B为盐酸、I为FeCl2,J为FeCl3,故B为HCl、气体单质D为H2,金属A与盐酸反应得到C为盐,能与氨气反应得到白色沉淀F,且白色沉淀F溶于氢氧化钠溶液得到G,可推知A为Al、C为AlCl3、F为Al(OH)3、G为NaAlO2,据此解答。
(1)由上述分析可知,D为H2,I为FeCl2,
故答案为:H2;FeCl2;
(2)C为AlCl3,其与NH3·H2O反应生成氢氧化铝和氯化铵,其离子反应方程式为:![]() ;
;
故答案为:![]() ;
;
(3)J为FeCl3,其与NaOH溶液反应生成氢氧化铁和氯化钠,其离子反应方程式为:![]() ,
,
故答案为:![]() ;
;
(4)I为FeCl2,其与NaOH溶液反应会生成氢氧化亚铁,氢氧化亚铁极易被空气氧化而生成氢氧化铁,其现象为:产生白色沉淀,迅速变成灰绿色最后变成红褐色,
故答案为:产生白色沉淀,迅速变成灰绿色最后变成红褐色。


科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的的是
A. 将蔗糖和稀![]() 加热水解后的液体取出少许,加入新制
加热水解后的液体取出少许,加入新制![]() 悬浊液并加热煮沸,无红色沉淀生成,证明蔗糖未发生水解生成葡萄糖
悬浊液并加热煮沸,无红色沉淀生成,证明蔗糖未发生水解生成葡萄糖
B. 蛋白质溶液中加入酒精可以使蛋白质从溶液中析出,再加水又能溶解
C. 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质
D. 向淀粉溶液中加入稀![]() ,水浴加热一段时间后,取出部分水解液滴加碘水,若溶液变蓝,证明淀粉未发生水解
,水浴加热一段时间后,取出部分水解液滴加碘水,若溶液变蓝,证明淀粉未发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是
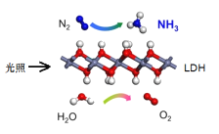
A.该过程中H2O被还原生成氧气
B.该过程中涉及极性键和非极性键的断裂与生成
C.基于合成NH3的过程属于氮的固定
D.该过程的化学方程式为:2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)古代的“药金”外观与金相似,常被误认为是金子。其冶炼方法如下:将碳酸锌、赤铜(Cu2O)、木炭按一定比例混合加热到800℃,即得金光闪闪的“药金”。
①“药金”的主要成分是__(填化学式)。
②有关冶炼的化学方程式是__。
(2)某地出产的孔雀石的主要成分是Cu2(OH)2CO3。
①试写出该孔雀石在加热条件下分解的化学方程式:__。
②试以①中所得金属氧化物为原料,分别采用湿法冶炼和高温冶炼的方法制取金属铜。供选择的试剂有木炭、铁屑、生石灰、稀硫酸,不得另选其他试剂。写出两种方法制取金属铜的化学方程式。
a.湿法冶炼:__、__(可不填满,也可补充,下同)。
b.高温冶炼:__。
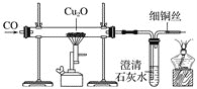
(3)利用一氧化碳还原赤铜矿(Cu2O)冶炼铜。实验室可用如图所示装置进行实验,当硬质玻璃管中的反应结束时,应进行的实验操作是___。
(4)利用辉铜矿(Cu2S)冶炼铜的原理如下:
Ⅰ.取一定质量的Cu2S在空气中高温焙烧,完全反应后生成一种铜的氧化物和二氧化硫;
Ⅱ.再取上述一半质量的Cu2S,与Ⅰ中生成的铜的氧化物混合均匀,隔绝空气高温煅烧,恰好完全反应,生成铜和二氧化硫。结合质量守恒定律,推断这种铜的氧化物的化学式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。
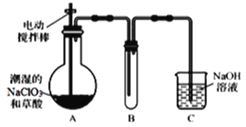
(1)实验时装置A需在60℃~100℃进行的原因是_________,控制所需温度的方法是________。
(2)装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___________。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为Zn-Cu原电池的示意图,请回答:
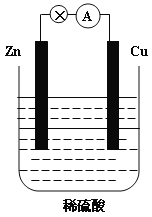
(1)锌片为原电池的______________(填“正”或“负”)极,该极的电极反应式是___________。该反应属于_______________(填“氧化”或“还原”)反应。
(2)__________(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+的从_________(填“锌片”或“铜片”)获得电子。
(3)原电池工作一段时间后,H2SO4溶液的浓度_________(填“增大”或“减小”,下同),烧杯中溶液的质量__________。
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为_________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是
A | B | C | D |
|
|
|
|
烧杯中产生白色沉淀,一段时间后沉淀无明显变化 | 加盐酸出现白色浑浊,加热变澄清 | KMnO4 酸性溶液在苯和甲苯中均褪色 | 液体分层,下层呈 无色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 增大压强,正逆反应的化学反应速率都减小
C. 升高温度, 正反应化学反应速率增大, 逆反应化学反应速率减小
D. 对该反应来说,无论反应进行到何时,混合气体的总物质的量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com