
| A. | 氮气化学性质不活泼,可用作食品防腐剂 | |
| B. | 硅胶无毒、无味、无腐蚀性,可用作食品干燥剂 | |
| C. | SiO2、Al2O3、MgO都有很高的熔点,可以制耐火材料 | |
| D. | 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 |
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | BaSO4?Ba2++SO42- | B. | HF═H++F- | ||
| C. | HI?H++I- | D. | NaHCO3═Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200ml 0.1mol/LFeCl3溶液 | B. | 100ml 0.1mol/L MgCl2溶液 | ||
| C. | 200ml 0.1mol/L NaCl溶液 | D. | 100ml 0.4mol/L BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③ | C. | ①②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v1、v2、K1、K2同时增大 | B. | v1、v2、K1、K2同时减小 | ||
| C. | v1、v2增大,K1增大,K2减小 | D. | v2减小,v1增大,K1增大,K2减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
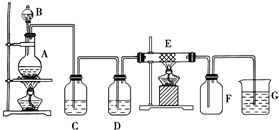 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
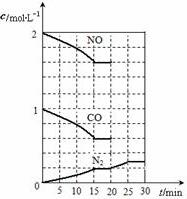 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com