
| A. | 同温度下,CuS的溶解度大于ZnS的溶解度 | |
| B. | 将足量CuSO4溶解在0.1 mol•L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol•L-1 | |
| C. | 因为H2SO4是强酸,故CuSO4+H2S═CuS↓+H2SO4不能发生 | |
| D. | 除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
分析 三种物质的化学式形式相同,可以直接通过溶度积常数比较二者的溶解度,根据溶度积常数计算溶液中的离子浓度,从溶解平衡移动的角度分析.
解答 解:A.ZnS与CuS的化学式形式相同,可以直接通过溶度积常数比较二者的溶解度,Ksp越小,溶解度越小,故A错误;
B.将足量CuSO4溶解在0.1 mol•L-1的H2S溶液中,生成CuS沉淀后,溶液为硫酸铜溶液,Cu2+的最大浓度应为饱和溶液的浓度,故B错误;
C.由于CuS是难溶于酸的沉淀,反应符合复分解条件,能发生,故C错误;
D.FeS的溶度积大于CuS的溶度积,其溶解平衡的S2-浓度远大于CuS的S2-离子浓度,故加入FeS可以沉淀废水中的Cu2+,故D正确.
故选D.
点评 本题综合考查难溶电解质的溶解平衡问题,题目难度中等,注意把握溶度积的定义的理解和计算的应用,易错点为B.


科目:高中化学 来源: 题型:选择题
| A. | 三种元素的最高正化合价中,Z的最大 | |
| B. | W溶液显碱性或中性 | |
| C. | 原子半径:X>Y>Z | |
| D. | Y的最高价氧化物对应的水化物是强酸. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃,电离平衡常数:
25℃,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=1.5×10-2 K2=1.0×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
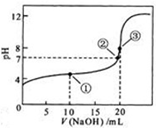
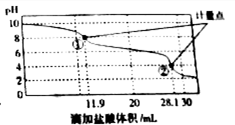 称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )
称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )| A. | 样品中Na2CO3含量越高,起始pH也越大 | |
| B. | 计量点①中有关离子浓度关系为:c(HCO3-)>C(Cl-)>c(CO32-) | |
| C. | 计量点②溶液中有关离子浓度关系为:2(CO32-)+c(HCO3-)=C(H+)-c(OH-) | |
| D. | 此样品n(NaHCO3)=(28.1-11.9)×10-3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
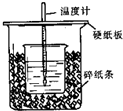 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
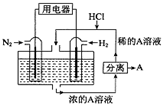 科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )
科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )| A. | 该电池外电路电流从通入H2的电流流向通入N2的电极 | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 通入N2的电极发生的电极反应式为:N2+6e-+8H+═2NH4+ | |
| D. | 通入H2的电极为负极,A为NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
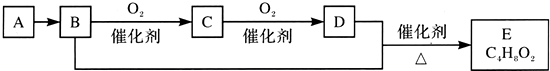
| A. | 鉴别A和甲烷可选择使用酸性高锰酸钾溶液 | |
| B. | D中含有的官能团为羧基,利用D物质可以清除水壶中的水垢 | |
| C. | 物质C的结构简式为CH3CHO,E的名称为乙酸乙酯 | |
| D. | B+D→E的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{催化剂}$CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
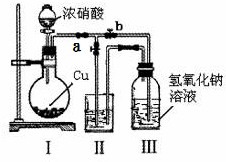 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com