
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,A在反应中既不容易得电子也不容易失电子,元素B的最外层电子数是电子层数的3倍,元素D与A为同族元素,元素C和E形成的化合物CE是海水中的主要成分。下列说法不正确的是
A.离子半径:r(E)>r(B)>r(C)
B.熔点:CE>DE4
C.C与B形成的两种化合物中化学键类型不同
D.A、D、E的最高价氧化物对应水化物的酸性逐渐增强
D
【解析】
试题分析: A在反应中既不容易得电子也不容易失电子,因此A是第ⅣA族元素,元素D与A为同族元素,所以根据原子序数A小于D可知,A应该是碳元素,则D是硅元素。元素B的最外层电子数是电子层数的3倍,原子序数大于碳元素而小于硅元素,则B是氧元素。元素C和E形成的化合物CE是海水中的主要成分,因此C是钠元素,E是氯元素。A、离子的核外电子层数越多,离子半径越大。核外电子排布相同的微粒离子半径随原子序数的增大而减小,因此离子半径:r(E)>r(B)>r(C),A正确;B、氯化钠形成的晶体是离子晶体,四氯化硅形成的晶体是分子晶体,因此熔点CE>DE4,B正确;C、C与B形成的两种化合物是氧化钠和过氧化钠,前者含有离子键,后者含有离子键和非极性键,中化学键类型不同,C正确;D、非金属性越强,最高价氧化物对应水化物的酸性逐渐增强,非金属是Cl>C>Si,所以D、A、E的最高价氧化物对应水化物的酸性逐渐增强,D不正确,答案选D。
考点:考查位置、结构与性质的应用


科目:高中化学 来源:2013-2014四川省成都市五校高二下学期期中联考化学试卷(解析版) 题型:推断题
每年夏季,农民焚烧植物秸秆(主要成分是纤维素),既污染了环境,又浪费了资源,工业上以植物秸秆为原料合成某聚酯化合物的路线如下:
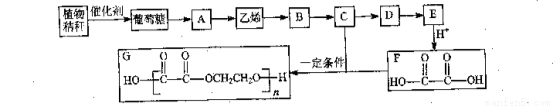
已知A是常见的消毒剂,又可作为能源。
(1)乙烯中官能团的结构式为___________;葡萄糖分子中官能团的电子式为_______________;
(2)由B转化为C的反应条件是________________;C转化为D的反应类型是___________;
(3)测定D中所含官能团的物理方法是__________;若B是氯代烃,其系统命名法的名称是_______;
(4)写出下列反应方程式:
A:由植物秸秆转化成葡萄糖________________________________________________;
B:由A转化成乙烯__________________________________________________;
C:生成聚酯化合物__________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
DDT是人类合成得到的第一种有机农药,它的结构简式如下图所示,有关它的说法正确的是
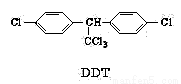
A.它属于芳香烃
B.分子式为C14H8Cl5
C.1mol该物质能与6mol H2加成
D.分子中最多可能有27个原子共面
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
下面是关于中和滴定的实验叙述:取25.00 mL未知浓度的HCl溶液。在横线标明操作中,有错误的是
a.放入锥形瓶中,此瓶需事先用蒸馏水洗净。 b.并将该瓶用待测液润洗过。
c.加入几滴酚酞作指示剂。 d.取一支酸式滴定管,经蒸馏水洗净。
e.直接往其中注入标准NaOH溶液,进行滴定。
f.一旦发现溶液由无色变成粉红色,即停止滴定,记下数据。
A.d、e、f B.b、d、e、f C.b、d、e D.b、c、e、f
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:推断题
(15分)有机物E与铜(Ⅱ)的配合物是一种可发光的发光材料,在发光器材方面有很好的应用前景。其合成E的路线如下:
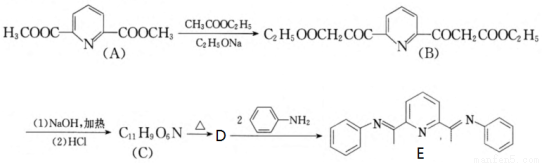
回答下列问题:
(1)B生C的反应类型有 。
(2)A有多种同分异构体,其中符合以下条件的共有 种。
①分子中含有吡啶环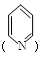 且环上只有2个取代基;
且环上只有2个取代基;
②只含有一种官能团,且核磁共振氢谱只有四种峰;
③吡啶环上的一氯取代物只有2种。
(3)C生成D的过程中有一种温室气体生成,则D的结构简式为 。
(4)写出D生成E的化学方程式 。
(5)结合题给信息,以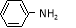 和
和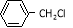 为原料合成西佛碱N-苯基苯甲亚胺(
为原料合成西佛碱N-苯基苯甲亚胺(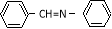 ),请你拟出合成路线: 。
),请你拟出合成路线: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:填空题
(12分)铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁
与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物
为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析
下图,回答有关问题。
假设曲线的各段内只有一种还原产物。
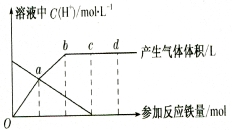
(1)0点到a点的还原产物是 ________ __ 。
(2)a点到b点的还原产物是__ __,其原因是 。
(3)试完成b点到c点的反应方程式:
口Fe+口HNO3——口Fe( NO3)3+口[ ]+口H20。
(4)反应过程中,到达 ________ 点时,HN03已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是 。
(6)c点和d点参加反应的铁的物质的量之比是 ___________ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:选择题
V1ml、0.2 mol/L Na2SO4溶液和V2ml、0.1 mol/L Fe2(SO4)3溶液混合,已知V1大于V2 ,则混合溶液中SO42-的物质的量浓度可能是
A.0.23 mol/L B.0.18 mol/L C.0.26 mol/L D.0.25 mol/L 1
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列四个数据都表示合成氨的反应速率,其中代表同一反应速率的是
①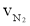 = 0.3mol·L-1·min-1 ②
= 0.3mol·L-1·min-1 ②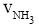 = 0.9 mol·L-1·min-1
= 0.9 mol·L-1·min-1
③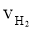 = 0.015 mol·L-1·s-1 ④
= 0.015 mol·L-1·s-1 ④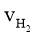 = 2.25 mol·L-1·min-1
= 2.25 mol·L-1·min-1
A.①②B.①③C.③④D.②④
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H = + 74.9 kJ·mol-1,下列说法中正确的是
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com