
| | 混合物 | 试剂 | 分离方法 |
| A | Fe(碘) | — | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源:不详 题型:实验题
 丁醇,查阅资料得知一条合成路线:
丁醇,查阅资料得知一条合成路线: CH2+CO+H2
CH2+CO+H2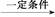 CH3CH2CH2CHO
CH3CH2CH2CHO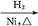 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;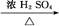 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。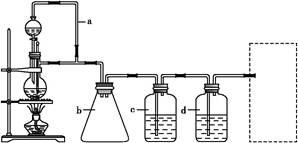
 丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: , 。
丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: , 。  丁醇粗品。为纯化1
丁醇粗品。为纯化1 丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)
丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)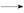 RCH(OH)SO3Na↓;②沸点:乙醚34℃,1
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1 丁醇 118℃,并设计出如下提纯路线:
丁醇 118℃,并设计出如下提纯路线: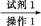 滤液
滤液
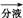 有机层
有机层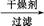 1
1 丁醇、乙醚
丁醇、乙醚 纯品
纯品查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.用装置I除去CO2中的SO2 | B.实验室用装置II制备NH3 |
| C.用装置III制备乙烯 | D.装置IV比较酸性H2CO3>苯酚 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
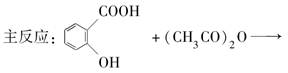
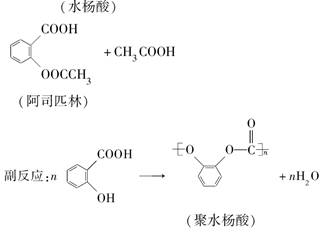
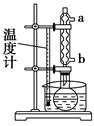
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | NH3(H2O) | 浓硫酸 | 洗气 |
| B | H2O(Br2) | CCl4 | 分液 |
| C | KCl固体(I2) | KOH溶液 | 加热 |
| D | MgCl2溶液(FeCl3) | NaOH溶液 | 过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.可用装置①除去碳酸钠中的碳酸氢钠 |
| B.可用装置②分离汽油和水的混合物 |
| C.可用装置③从海水中蒸馏得到淡水 |
| D.可用装置④把胶体粒子从分散系中分离出来 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 物质 | 杂质 | 试剂 | 主要操作 |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | NaHCO3 | NH4Cl | — | 加热 |
| C | 铁粉 | 铜粉 | 稀硫酸 | 过滤 |
| D | 甲烷 | 乙烯 | 溴水 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com