
【题目】LiFePO4、聚乙二醇、LiPF6、LiAsF6、LiCl等常用作锂离子聚合物电池的材料和载体。
回答下列问题:
(1)LiFePO4中Fe的价层电子排布式为___________。
(2)LiPF6、LiAsF6和LiCl中所含的四种非金属元素电负性由大到小的顺序为___________。
(3)含氧酸的通式可写为(HO)mROn,根据化学学科的规律下列几种酸中酸性与H3PO4相近的有________。
a.HClO b.HClO3 c.H2SO3 d.HNO2
(4)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(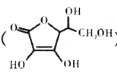 )常被用作碳包覆的碳源,其易溶于水的原因是____________________,该分子中碳原子的杂化方式为___________。
)常被用作碳包覆的碳源,其易溶于水的原因是____________________,该分子中碳原子的杂化方式为___________。
(5)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)
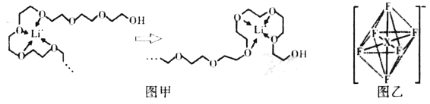
①从化学键角度看,Li+迁移过程发生___________(填“物理变化”或“化学变化”)。
②相同条件,Li+在___________(选填“LiPF6”或“LiAsF6”)中迁移较快,原因是___________。
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)晶胞参数为0.72mm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。
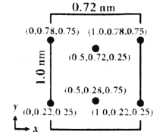
①该晶胞中Cl原子的数目为___________。
②LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则LiCl·3H20晶体的密度为___g·cm-3(列出计算表达式)。
【答案】3d6 F > Cl > P > As cd 抗坏血酸分子含有多个羟基,与水形成分子间氢键 sp2 、sp3 化学变化 LiAsF6 AsF6-的半径比PF6-的大,AsF6-与Li+的作用力比PF6-弱 4 ![]()
【解析】
(1)26Fe的价层电子为最外层加上次外层d能级上的电子,所以价层电子为排布式为3d64s2,那么LiFePO4中Fe显+2价,失去最外层电子,LiFePO4中Fe的价层电子排布式为3d6;答案为3d6。
(2)同周期自左而右电负性增大、同主族自上而下电负性减小,故电负性:F>P>As>Li;答案为F>P>As>Li。
(3)H3PO4可改写为(HO)3PO1,非羟基氧原子数为1,
a.HClO可改写为(HO)ClO0,非羟基氧原子数为0;
b.HClO3可改写为(HO)ClO2,非羟基氧原子数为2;
c.H2SO3可改写为(HO)2SO1,非羟基氧原子数为1;
d.HNO2可改写为(HO)NO1,非羟基氧原子数为1;
非羟基氧原子数相同,酸性相近,故cd与H3PO4的非羟基氧原子数相同,酸性相近;答案为cd。
(4)抗坏血酸分子中含有多个羟基,可以与水分子形成分子间氢键;由抗坏血酸的分子结构可知该分子中存在碳碳双键和碳碳单键,则碳原子的杂化方式有两种sp2、sp3;答案为抗坏血酸分子含有多个羟基,与水形成分子间氢键,sp2、sp3。
(5)①从图甲看出,Li+迁移过程生成了新物质,发生了化学变化;答案为化学变化。
②因为PF6-的半径比AsF6-的小,PF6-与Li+的作用力就比AsF6-的强,迁移速度就慢;答案为LiAsF6;PF6-的半径比AsF6-的小,PF6-与Li+的作用力就比AsF6-的强,迁移速度就慢。
(6)原子分数坐标为(0.5,0.2,0.5)的Cl原子位于晶胞体内,原子分数坐标为(0,0.3,0.5)及(1.0,0.3,0.5)的Cl原子分别位于晶胞的左侧面、右侧面上,原子分数坐标为(0.5,0.8,1.0)及(0.5,0.8,0)的Cl原子分别位于晶胞的上底面、下底面,原子分数坐标为(0,0.7,1.0)及(1.0,0.7,1.0)(0,0.7,0)及(1.0,0.7,0)的Cl原子位于晶胞平行于y轴的棱上,则晶胞中Cl原子数目为:1+4×![]() +4×
+4×![]() =4,根据Cs守恒有n(LiCl3H2O)=n(Cl)=
=4,根据Cs守恒有n(LiCl3H2O)=n(Cl)=![]() mol,晶胞的质量m=nM=
mol,晶胞的质量m=nM=![]() g,晶胞体积V=abc×10-27cm3=0.72×1.0×0.56×10-27cm3,晶体密度ρ=
g,晶胞体积V=abc×10-27cm3=0.72×1.0×0.56×10-27cm3,晶体密度ρ=![]() =
=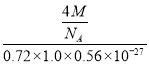 =
=![]() (gcm-3);答案为:4,
(gcm-3);答案为:4,![]()


科目:高中化学 来源: 题型:
【题目】填写下列空格。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要____(填“放出”或“吸收”)___kJ的热量。
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图____(填“甲”或“乙”)。
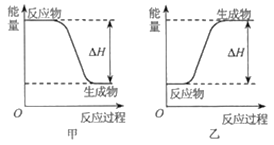
(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的H___(填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol·L-1 NaOH溶液480 mL和一定浓度的硫酸溶液。根据这两种溶液的配制情况回答下列问题:
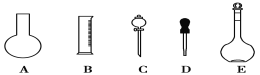
(1)如图所示的仪器中配制溶液肯定不需要的是___(填序号),配制上述溶液还需用到的玻璃仪器是___(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”、“<”或“=”)0.3 mol·L-1。
(3)实验室采购了98%(ρ=1.84gcm﹣3)的硫酸配制3.68molL﹣1的硫酸溶液500mL需准确量取98%的硫酸_____mL;
(4)该同学实际配制硫酸溶液的浓度为3.50 mol·L-1,原因可能是___________(填序号)。
A.用胶头滴管加水时俯视刻度 B.容量瓶中原来存有少量水
C.稀释硫酸的烧杯,溶液转移后未洗涤 D.用胶头滴管加水定容时仰视刻度
(5)若在滴加蒸馏水时,不慎超过了刻度线,此时应如何处理?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从物质A(某正盐)的水溶液出发有下面所示的一系列变化:
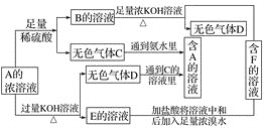
(1)写出A~F物质的化学式:
A__________;B__________;C__________;D__________;E.__________;F__________。
(2)写出E→F的化学方程式______________________________。
(3)鉴别物质F中阴离子的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入一定物质的量的A气体,发生反应 a A(g)![]() b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A) 变为原平衡的60%,下列说法不正确的是
b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A) 变为原平衡的60%,下列说法不正确的是
A.化学计量数之间的关系:a>b+c
B.平衡向正反应方向移动
C.物质B的体积分数减小
D.平衡移动过程中,与原平衡相比υ正减小、υ逆减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明了一种“可固氮”的镁-氮二次电池,其装置如图所示,下列说法不正确的是( )

A.固氮时,电池的总反应为3Mg+N2=Mg3N2
B.脱氮时,钌复合电极的电极反应式为Mg3N2-6e-=3Mg2++N2
C.固氮时,外电路中电子由钌复合电极流向镁电极
D.当无水LiCl—MgCl2混合物受热熔融后电池才能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯(Pd)可作汽车尾气CO、NO和HC(碳氢化合物)转化的催化剂。Pd负载量不同或不同工艺制备的纳米Pd对汽车尾气处理的结果如下图所示。下列说法不正确的是

A. 图甲表明,其他条件相同时,三种尾气的转化率随Pd负载量的增大先升后降
B. 图乙表明,尾气的起燃温度随Pd负载量的增大先降后升
C. 图甲和图乙表明,Pd负载量越大催化剂活性越高
D. 图丙和图丁表明,工艺2制得的催化剂Pd的性能优于工艺1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( )
A.-488.3kJ/molB.+488.3kJ/molC.+191kJ/molD.-191kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com