
¹¤ŅµÖĘĻõĖįµÄÖ÷ŅŖ·“Ó¦ĪŖ£ŗ4NH3£Øg£©+5O2£Øg£© 4NO£Øg£©+6 H2O£Øg£©”÷H”£
4NO£Øg£©+6 H2O£Øg£©”÷H”£
£Ø1£©ŅŃÖŖĒāĘųµÄČ¼ÉÕČČĪŖ285£®8 kJ/mol”£
N2£Øg£©+3H2£Øg£©=2NH3£Øg£©? ”÷H=£92£®4 kJ/mol;
H2O£Ø1£©=H2O£Øg£©”÷H=+44£®0 kJ/mol;
N2£Øg£©+O2£Øg£©=2NO£Øg£©”÷H=+180£®6 kJ/mol”£
ŌņÉĻŹö¹¤ŅµÖĘĻõĖįµÄÖ÷ŅŖ·“Ó¦µÄ”÷H=???????????????????????? ”£
£Ø2£©ŌŚČŻ»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬ČŻĘ÷ÄŚ²æ·ÖĪļÖŹµÄĪļÖŹµÄĮæÅضČČēĻĀ±ķ£ŗ

¢Ł·“Ó¦ŌŚµŚ2 minµ½µŚ4 minŹ±£¬O2µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ?????????????????? ”£
¢Ś·“Ó¦ŌŚµŚ6 minŹ±øıäĮĖĢõ¼ž£¬øıäµÄĢõ¼žæÉÄÜŹĒ????????? £ØĢīŠņŗÅ£©”£
A£®Ź¹ÓĆ“ß»Æ¼Į????? B£®ÉżøßĪĀ¶Č? C£®¼õŠ”Ń¹Ēæ????? D£®Ōö¼ÓO2µÄÅضČ
¢ŪĻĀĮŠĖµ·ØÖŠÄÜĖµĆ÷4NH3£Øg£©+5O2£Øg£© 4NO£Øg£©+6 H2 O£Øg£©“ļµ½Ę½ŗāדĢ¬µÄŹĒ??????? £ØĢīŠņŗÅ£©”£
4NO£Øg£©+6 H2 O£Øg£©“ļµ½Ę½ŗāדĢ¬µÄŹĒ??????? £ØĢīŠņŗÅ£©”£
A£®µ„Ī»Ź±¼äÄŚÉś³Én mol NOµÄĻņŹ±£¬Éś³Én mol NH3
B£®Ģõ¼žŅ»¶Ø£¬»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ±ä»Æ
C£®°Ł·Öŗ¬Įæw£ØNH3£©=w£ØNO£©
D£®·“Ó¦ĖŁĀŹv£ØNH3£©£ŗu£ØO2£©£ŗv£ØNO£©£ŗv£ØH2O£©=4£ŗ5£ŗ4£ŗ6
E£®ČōŌŚŗćĪĀŗćŃ¹ĻĀČŻ»żæɱäµÄČŻĘ÷ÖŠ·“Ó¦£¬»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁ±ä»Æ
£Ø3£©Ä³ŃŠ¾æĖł×é×°µÄCH3OH£O2Č¼ĮĻµē³ŲµÄ¹¤×÷ŌĄķČēĶ¼ĖłŹ¾”£

¢ŁøƵē³Ų¹¤×÷Ź±£¬bæŚĶØČėµÄĪļÖŹĪŖ____????? ”£
¢ŚøƵē³ŲÕż¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ???????????????????????? ”£
¢ŪŅŌ“Ėµē³Ų×÷µēŌ“£¬ŌŚŹµŃéŹŅÖŠÄ£ÄāĀĮÖĘĘ·±ķĆę”°¶Ū»Æ”±“¦Ąķ£Ø×°ÖĆČēĶ¼ĖłŹ¾£©µÄ¹ż³ĢÖŠ£¬·¢ĻÖČÜŅŗÖš½„±ä»ė×Ē²¢ÓŠĘųÅŻ²śÉś£¬ĘäŌŅņæÉÄÜŹĒ?????????????????????????????????? £ØÓĆĻą¹ŲµÄĄė×Ó·½³ĢŹ½±ķŹ¾£©”£

£Ø1£©£904.8kJ”¤mol£1?? £Ø2£©¢Ł0.1875mol/(L”¤min)? ¢ŚB?? ¢Ū ABE
£Ø3£©¢ŁCH3OH? ¢ŚO2£«4e££«4H£«=2H2O? ¢ŪAl3£«£«3HCO3£=Al(OH)3£«3CO2(Al£3e££«3HCO3-Al(OH)3£«3CO2Ņ²øų·Ö)
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©H2£Øg£©+1/2O2£Øg£©ØTH2O£Øl£©”÷H=£285.8kJ”¤mol£1¢Ł
N2£Øg£©+3H2£Øg£©??? 2NH3£Øg£©? ”÷H=£92£®4 kJ/mol????? ¢Ś
H2O£Ø1£©??? H2O£Øg£©”÷H=+44£®0 kJ/mol??????? ¢Ū
N2£Øg£©+O2£Øg£©??? 2NO£Øg£©”÷H=+180£®6 kJ/mol? ¢Ü
øł¾ŻøĒĖ¹¶ØĀÉ£¬ÓÉ·½³ĢŹ½¢Ł”Į6£¢Ś”Į2¢Ū”Į6+¢Ü”Į2µĆ¹¤ŅµÖĘĻõĖįµÄÖ÷ŅŖ·“Ó¦ĪŖ£ŗ4NH3£Øg£©+5O2£Øg£©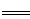 4NO£Øg£©+6 H2O£Øg£©”÷H£½£904.8kJ”¤mol£1£»
4NO£Øg£©+6 H2O£Øg£©”÷H£½£904.8kJ”¤mol£1£»
£Ø2£©£©¢Ł°±ĘųµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹĪŖv=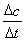 =
=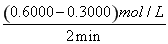 =0.015 mol”¤L£1”¤min£1£¬Ķ¬Ņ»»Æѧ·“Ó¦Ķ¬Ņ»Ź±¼ä¶ĪÄŚ£¬ø÷ĪļÖŹµÄ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌŃõĘųµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹĪŖ0.1875mol”¤L£1”¤min£1£»
=0.015 mol”¤L£1”¤min£1£¬Ķ¬Ņ»»Æѧ·“Ó¦Ķ¬Ņ»Ź±¼ä¶ĪÄŚ£¬ø÷ĪļÖŹµÄ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌŃõĘųµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹĪŖ0.1875mol”¤L£1”¤min£1£»
¢ŚĶعżĶ¼±ķ±Č½ĻĘšŹ¼µ½µŚ6minŗĶµŚ6minµ½µŚ8minŹ±ÖŖ£¬·“Ó¦ĪļÅØ¶Č±ä“óŗĶÉś³ÉĪļÅØ¶Č±äŠ”£¬ÄęĻņŅĘ¶Æ£¬ĖłŅŌøıäµÄĢõ¼žŹĒÉżøßĪĀ¶Č£»BÕżČ·£¬Ź¹ÓĆ“ß»Æ¼Į£¬Ę½ŗā²»ŅĘ¶Æ£¬A“ķĪó£»¼õŠ”Ń¹ĒæŗĶŌö¼ÓO2µÄÅØ¶Č£¬ÕżĻņŅĘ¶Æ£¬CD“ķĪó£»¹Ź“š°øĪŖ£ŗB£»
¢ŪA£®µ„Ī»Ź±¼äÄŚÉś³Én mol NOµÄĻņŹ±£¬Éś³Én mol NH3£¬ĖµĆ÷vÕż=vÄę£¬AÕżČ·£»
B£®Ģõ¼žŅ»¶Ø£¬»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ±ä»Æ£¬·½³ĢŹ½Į½±ßĘųĢåµÄ»Æѧ¼ĘĮæŹżÖ®ŗĶ²»ĻąµČ£¬ĘųĢåµÄĪļÖŹµÄĮæŹĒøö±ä»ÆµÄĮ棬ĘųĢåµÄÖŹĮæŹ¼ÖÕ²»±ä£¬ĖłŅŌ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä£¬Ö¤Ć÷ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬“ļµ½ĮĖĘ½ŗāדĢ¬£¬BÕżČ·£»
C£®°Ł·Öŗ¬Įæw£ØNH3£©=w£ØNO£©£¬²»ÄÜĖµĆ÷vÕż=vÄę£¬C“ķĪó£»
D£®·“Ó¦ĖŁĀŹv£ØNH3£©£ŗu£ØO2£©£ŗv£ØNO£©£ŗv£ØH2O£©=4£ŗ5£ŗ4£ŗ6£¬²»ÄÜĖµĆ÷vÕż=vÄę£¬D“ķĪó£»
E£®ÓÉÓŚ·“Ó¦·½³ĢŹ½Į½±ßĘųĢåµÄÖŹĮæ²»±ä£¬ČŻĘ÷µÄČŻ»ż²»±ä£¬ĖłŅŌ»ģŗĻĘųĢåµÄĆܶČæɱ䣬Ņņ“Ė»ģŗĻĘųĢåµÄĆܶȏĒŅ»øö±äĮ棬æÉŅŌÅŠ¶ĻŹĒ·ń“ļµ½ĮĖĘ½ŗāדĢ¬£¬EÕżČ·£»
£Ø3£©¢ŁŌŚ¼×“¼Č¼ĮĻµē³ŲÖŠ£¬Č¼ĮĻ¼×“¼×÷øŗ¼«£¬ŃõĘų×÷Õż¼«£¬µē½āÖŹÖŠµÄŃōĄė×ÓŅĘĻņÕż¼«£¬ĖłŅŌcæŚĶØČėµÄĪļÖŹĪŖŃõĘų£¬bæŚĶØČėµÄĪļÖŹĪŖ¼×“¼£»? ¢ŚøƵē³ŲÕż¼«ŹĒŃõĘų·¢ÉśµĆµē×ӵĻ¹Ō·“Ó¦£¬µē¼«·“Ó¦Ź½ĪŖ£ŗO2+4e£+4H£«=2H2O£¬? ¢ŪŌŚµē½ā³ŲÖŠ£¬½šŹōĀĮĪŖŃō¼«£¬·¢Éśµē¼«·“Ó¦£ŗAl”śAl3£«+3e££¬ĀĮĄė×Ó»įŗĶĢ¼ĖįĒāøłĄė×ÓÖ®¼ä·¢ÉśĖ«Ė®½ā·“Ӧɜ³ÉĒāŃõ»ÆĀĮ³ĮµķŗĶ¶žŃõ»ÆĢ¼£¬¼“Al3£«+3HCO3£=Al£ØOH£©3”ż+3CO2”ü£¬ČÜŅŗÖš½„±ä»ė×Ē£¬¹Ź“š°øĪŖ£ŗAl3£«£«3HCO3£=Al(OH)3£«3CO2(Al£3e££«3HCO3£=Al(OH)3£«3CO2)”£
æ¼µć£ŗæ¼²éѧɜӊ¹Ų»Æѧ·“Ó¦ŌĄķµÄ×ŪŗĻĢāÄ攣



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |

| Ź±¼ä/ÅØ¶Č | c£ØNH3£© £Ømol/L£© | c£ØO2 £© £Ømol/L£© | c£ØNO£© £Ømol/L£© |
| ĘšŹ¼ | 0.8 | 1.6 | 0 |
| µŚ2min | 0.6 | a | 0.2 |
| µŚ4min | 0.3 | 0.975 | 0.5 |
| µŚ6min | 0.3 | 0.975 | 0.5 |
| µŚ8min | 0.7 | 1.475 | 0.1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| Ź±¼ä/ÅØ¶Č | c£ØNH3£©£Ømol/L£© | C£ØO2£©£Ømol/L£© | C£ØNO£©£Ømol/L£© |
| ĘšŹ¼ | 0.8 | 1.6 | 0 |
| µŚ2min | 0.6 | a | 0.2 |
| µŚ4min | 0.3 | 0.975 | 0.5 |
| µŚ6min | 0.3 | 0.975 | 0.5 |
| µŚ8min | 0.8 | 1.6 | 0.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| C4(NO)C6(H20) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H20) |
| C4(NH3)C5(O2) |

| Ź±¼ä/ÅØ¶Č | c£ØNH3£©£Ømol/L£© | C£ØO2£©£Ømol/L£© | C£ØNO£©£Ømol/L£© |
| ĘšŹ¼ | 0.8 | 1.6 | O |
| µŚ2min | 0.6 | a | O.2 |
| µŚ4min | O.3 | 0.975 | O.5 |
| µŚ6min | 0.3 | 0.975 | 0.5 |
| µŚ8min | 0.8 | 1.6 | O.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ÅØ¶Č Ź±¼ä |
c£ØNH3£© | c£ØO2£© | c£ØNO£© | c£ØH2O£© |
| ĘšŹ¼ | 4.0 | 5.4 | 0 | 0 |
| µŚ2min | 3.2 | 1 | 0.8 | 1.2 |
| µŚ4min | 2.0 | 3.0 | 2.0 | 3.0 |
| µŚ6min | 2.0 | 3.0 | 2.0 | 3.0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011½ģÉĻŗ£ŹŠĀ¬ĶåĒųøßČżÉĻŃ§ĘŚĘŚÄ©æ¼ŹŌ»ÆѧŹŌ¾ķ ĢāŠĶ£ŗĢīæÕĢā
¹¤ŅµÖĘĻõĖįµÄÖ÷ŅŖ·“Ó¦ŹĒ£ŗ4NH3(g)+5O2(g)  4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ
£Ø1£©øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖK=________________£»ÉżøßĪĀ¶ČKÖµ__________ £ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£
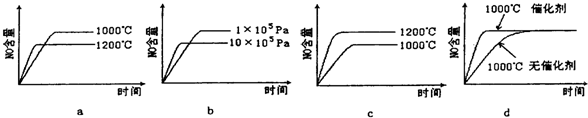
£Ø2£©Čō·“Ó¦ĪļĘšŹ¼µÄĪļÖŹµÄĮæĻąĶ¬£¬ĻĀĮŠ¹ŲĻµĶ¼“ķĪóµÄŹĒ________ £ØĢī×ÖÄøŠņŗÅ£©”£
£Ø3£©ŌŚČŻ»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬ČŻĘ÷ÄŚ²æ·ÖĪļÖŹµÄĪļÖŹµÄĮæÅضČČēĻĀ±ķ£ŗ
| Ź±¼ä£ÆÅØ¶Č | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| ĘšŹ¼ | 0.8 | 1.6 | 0 |
| µŚ2min | 0.6 | a | 0.2 |
| µŚ4min | 0.3 | 0.975 | 0.5 |
| µŚ6min | 0.3 | 0.975 | 0.5 |
| µŚ8min | 0.8 | 1.6 | 0.5 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com