
| A. | 4molA+2molB | B. | 2molA+1molB+2molC | ||
| C. | 2molC+1molB | D. | 1molA+0.5molB+1molC |
分析 反应2A(g)+B(g)?2C(g)中,在恒温恒容下,不同途径达到平衡后,C的浓度仍为Kmol/L,说明与原平衡为等效平衡,按化学计量数转化到方程式的左边,只有满足n(A)=2mol,n(B)=1mol即可,据此进行分析.
解答 解:A、该反应是气体体积不变的反应,压强不影响平衡,开始加入4molA+2molB,与加入2molA和1molB达平衡的平衡相比增大压强,平衡正向移动,所以达到平衡时C的浓度为大于K mol/L,故A错误;
B、开始加入2molA+1molB+2molC,按化学计量数转化到左边可得4molA、2molB,与加入2molA和1molB达平衡的平衡相比增大压强,平衡正向移动,所以达到平衡时C的浓度为大于K mol/L,故B错误;
C、开始加入2molC+1molB,按化学计量数转化到左边可得2molA、2molB,与原反应不是等效平衡,达到平衡时C的浓度为不是Kmol/L,故C错误;
D、开始加入1molA+0.5molB+1molC,按方程式的化学计量数转化到左边,可得2molA、1molB,与加入2molA和1molB达平衡的平衡为等效平衡,达到平衡时C的浓度为Kmol/L,故D正确;
故选D.
点评 考查化学平衡的有关计算、等效平衡,难度中等,构建平衡建立的途径是解题关键,注意等效平衡规律:1、恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡;2、恒温恒容下,若反应前后气体气体发生变化,按化学计量数转化到一边,满足对应物质的物质的量相等,为等效平衡;若反应前后气体的体积不变,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡.


科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
VL硫酸铁溶液中含Fe3+ 的质量为mg ,则此溶液中SO42- 的物质的量浓度为
A. B.
B. C.
C. D.
D.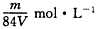
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| w(CaO)% NaOH浓度& 浸出率% 碱用量c/mol•L-1 | 0.1 | 1.3 | 1.3 | 2.7 |
| 30 | 30 | 40 | 40 | |
| 1.1 | 99.1 | 90.1 | 93.3 | 83.2 |
| 1.3 | 99.4 | 92.7 | 93.0 | 82.1 |
| 1.5 | 99.5 | 93.4 | 96.5 | 83.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 容量瓶规格 | 1000mL | 950mL | 500mL | 1000mL |
| CuSO4质量 | 152g | 152g | 80g | 160g |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | NaOH溶液与醋酸反应:H++OH-═H2O | |
| C. | 稀H2SO4与纯碱溶液反应:2H++Na2CO3═2Na++CO2↑+H2O | |
| D. | 少量二氧化碳与氢氧化钾反应:CO2+2OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碱性氧化物一定是金属氧化物,但酸性氧化物不一定都是非金属氧化物 | |
| B. | 胶体会产生电泳现象是因为胶体吸附带电离子而显电性 | |
| C. | 电解质与非电解质的本质区别是水溶液能否导电 | |
| D. | 离子反应是否能够发生要看离子之间能否发生复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com