
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1 ②3s23p2③3s23p3 ④3s23p4 第一电离能最大的是③ |
| C、①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ |
| D、某元素气态基态原子的逐级电离能(kJ?mol-1)分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1个甘氨酸分子中存在10对共用电子 |
| B、PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构 |
| C、维勒用无机物合成了尿素,突破了无机物与有机物的界限 |
| D、熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验结论 |
| (1)将混合物溶于水,得到无色透明溶液 | 原混合物肯定无 |
| (2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 原混合物肯定有 |
| (3)在另一份溶液中加入NaOH溶液,也产生白色沉淀 | 原混合物肯定有 |

查看答案和解析>>
科目:高中化学 来源: 题型:
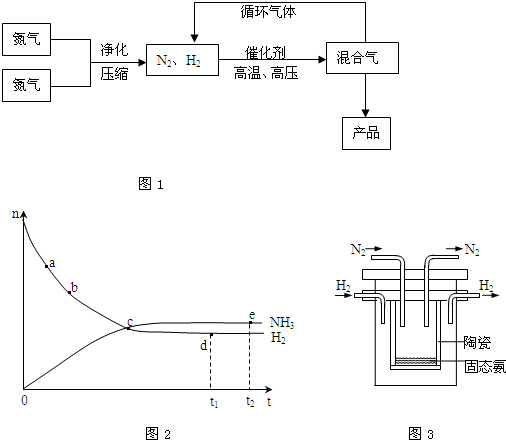
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液的pH=7 | ||
B、若混合溶液中c(H+)=
| ||
| C、若混合溶液pH=4,则水电离出的c(H+)=1.0×10-10mol?L-1 | ||
| D、若HA为强酸,则混合后溶液中各离子浓度的大小关系一定为:c(A-)>c(B+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com