
下表是元素周期表的一部分,下列有关说法正确的是( )
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | cd | ||||||
| 3 | abef |
A.a、b两元素的单质构成原电池两极时,a一定为负极
B.e的氢化物分子和d的氢化物分子不可能含有相同的电子数
C.六种元素中,c元素与其他三种非金属元素均能形成化合物
D.c、e、f的含氧酸的酸性依次增强
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是( )
A.若2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则H2的燃烧热为241.8 kJ·mol-1
B.若C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是( )
A.Th 元素的质量数是232
B.Th 元素的相对原子质量是231
C.232Th 转换成233U是化学变化
D.230Th和232Th的化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期。Z能与X形成两种常见的离子化合物,离子个数比均为2∶1。下列说法错误的是( )
A.Y、Z、X、W的原子序数依次减小
B.W与X可形成既含极性共价键又含非极性共价键的化合物
C.由W、X、Y、Z四种元素组成的常见化合物一定显酸性
D.X的简单氢化物的沸点低于Y的简单氢化物的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
元素 | 相关信息 |
X | X的最高价氧化物对应的水化物化学式为H2XO3 |
Y | Y是地壳中含量最高的元素 |
Z | Z的基态原子最外层电子排布式为3s23p1 |
W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 三 周期第 ⅣA 族;W的原子半径比X的 大 (填“大”或“小”)。
(2)Z的第一电离能比W的 小 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 分子间作用力(范德华力) ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 乙酸 。21教育网
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 先产生白色沉淀,后沉淀逐渐溶解,最后变成无色溶液 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是________________________________________________________________________。
(4)在25℃、101 kPa下,已知13.5 g的固体单质在Y2气体中完全燃烧后恢复至原状态,放热419 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为XYZ3W8。其中,只有W显负价。X、Y的最外层电子数之和与Z的最高正价数相等。Y3+与W的阴离子具有相同的电子层结构。X、W的质子数之和等于Y、Z的质子数之和。下列说法错误的是( )21·cn·jy·com
A.X的离子半径>Y的离子半径
B.Z的氢化物稳定性<W的氢化物稳定性
C.Y的氧化物既能与盐酸,又能与NaOH溶液反应
D.X2W2、Y2W3两种化合物含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
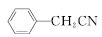 +H2O+H2SO4
+H2O+H2SO4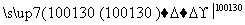
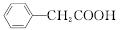 +NH4HSO4
+NH4HSO4
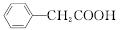 | |||
 | |||
+Cu(OH)2―→ +H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
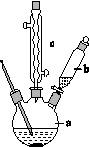
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是______________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是__________;仪器c的名称是__________,其作用是____________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是____________(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是____________,最终得到44 g纯品,则苯乙酸的产率是____________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是__________________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com