
分析 热化学方程式应注明物质的状态,物质的量与热量成正比,且焓变的数值、单位、符号缺一不可,以此来解答.
解答 解:(1)3molNO2(g)与1molH2O(l)反应生成HNO3(aq)和NO(g),放热138kJ,则热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol,故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol;
(2)用CO(g)还原1molFe2O3(s),放热24.8kJ,热化学方程式为3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H=-24.8kJ/mol,
故答案为:3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H=-24.8kJ/mol;
(3)1molHgO(s)分解为液态汞和氧气,吸热90.7kJ,热化学方程式为HgO(s)=Hg(l)+$\frac{1}{2}$O2(g)△H=+90.7kJ/mol,
故答案为:HgO(s)=Hg(l)+$\frac{1}{2}$O2(g)△H=+90.7kJ/mol;
(4)0.1molB2H6(g)在氧气中燃烧,生成固态B2O3和液态水,放热649.5kJ,则1molB2H6(g)在氧气中燃烧,生成固态B2O3和液态水,放热6495kJ,热化学方程式为 B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-6495kJ/mol,
故答案为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-6495kJ/mol.
点评 本题考查热化学方程式的书写,为高频考点,把握物质的状态、反应中能量变化为解答的关键,侧重分析与应用能力的考查,题目难度不大,注意焓变的正负.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
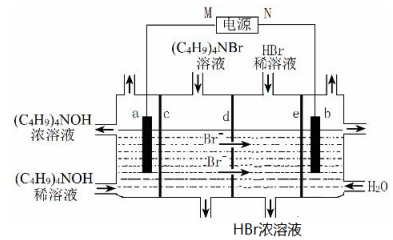
| A. | M为负极 | |
| B. | b极电极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c、e分别为阳离子交换膜和阴离子交换膜 | |
| D. | 制备 1mol(C4H9)4NOH,理论上 a极产生11.2L气体(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂可以提高该反应的焓变 | |
| B. | 增大O2的浓度可以提高反应速率和SO2的转化率 | |
| C. | 反应450℃时的平衡常数小于500℃时的平衡常数 | |
| D. | 2 mol SO2(g) 和1 mol O2(g)所含的总能量小于2 mol SO3(g) 所含的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 250mL2mol•L-1的氨水中含有NH3•H2O的分子数为0.5NA | |
| B. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA | |
| C. | 1 L 0.5 mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA | |
| D. | t℃时,pH=6 的纯水中含有OH-的个数为10-6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把相同大小的Al和Mg分别投入相同浓度的NaOH溶液中:Al溶解有气泡放出,而Mg没有任何变化.由此得出:Al的金属性比镁强 | |
| B. | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落.由此得出:铝不能燃烧 | |
| C. | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡.由此得出:该气体一定是氨气 | |
| D. | 向AlCl3溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失.由此得出:Al(OH)3能溶于强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{1000ρ×a%}{M}$×2 | B. | a=$\frac{cMV}{1000}$ | C. | c=$\frac{CM}{200ρ}$ | D. | V×ρ×a%=$\frac{cMV}{1000}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2是极性键构成的极性分子 | |
| B. | SO2与CO2为等电子体 | |
| C. | 金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高 | |
| D. | NaCl和CsCl的化学式相同,所以晶胞特点也是相同的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com