
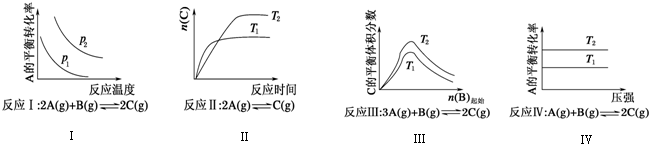
| A. | 反应Ⅰ:△H>0,p2>p1 | B. | 反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1 | ||
| C. | 反应Ⅱ:△H>0,T1>T2 | D. | 反应Ⅳ:△H<0,T2>T1 |
分析 A.反应Ⅰ说明升高温度,A的转化率降低,增大压强平衡向正反应方向移动;
B.反应Ⅲ中温度的高低与温度对平衡移动的影响有关;
C.反应Ⅱ由图象可以看出T1>T2,升高温度C的物质的量减少;
D.反应Ⅳ,由图象可以看出T2条件下A的转化率大,因此当T2>T1时,说明升高温度平衡向正反应方向进行,正反应为吸热反应△H>0,反应为放热反应.
解答 解:A.反应Ⅰ的特点是正反应方向为气体体积减小的方向,结合图象,压强增大A的转化率应增大,所以p2>p1,它随温度的升高A的转化率降低,所以正反应为放热反应△H<0,故A错误.
B.关于反应Ⅲ,由图象可以看出,T2条件下C的平衡体积分数大,因此当T2>T1时正反应为吸热反应△H>0,而当T2<T1时正反应为放热反应△H<0,故B正确;
C.关于反应Ⅱ由图象可以看出T1条件下达到平衡所用的时间少,所以T1>T2,而在T1条件下达平衡时n(C)小,所以说明低温有利于C的生成,故它主要的正反应为放热反应△H<0,故C错误;
D.关于反应Ⅳ,由图象可以看出T2条件下A的转化率大,因此当T2>T1时,说明升高温度平衡向正反应方向进行,因此正反应为吸热反应△H>0,故D错误.
故选B.
点评 本题考查外界条件对化学平衡的影响,题目难度中等,本题注意分析图象中曲线的变化趋势,结合方程式的特征以及外界条件对平衡移动的影响分析.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | A与B一定都是气体 | B. | 平衡向正反应方向移动了 | ||
| C. | 物质B的质量分数增加了 | D. | a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
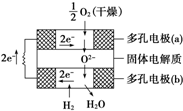 2010年10月上海世博会临近结束的时刻,燃料电池车成为世博会上冉冉升起的新星.燃料电池是一种新型电池,它主要是利用燃料在氧化过程中把化学能直接转化为电能.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,它已用于宇宙飞船及潜艇中.
2010年10月上海世博会临近结束的时刻,燃料电池车成为世博会上冉冉升起的新星.燃料电池是一种新型电池,它主要是利用燃料在氧化过程中把化学能直接转化为电能.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,它已用于宇宙飞船及潜艇中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
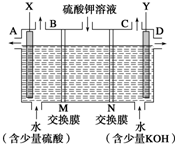 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
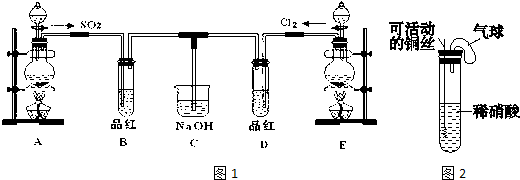
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
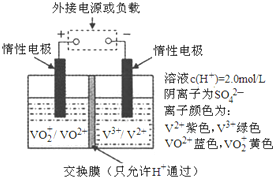 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种有毒气体,不能用于自来水的杀菌消毒 | |
| B. | 高纯度的二氧化硅晶体广泛用作制造光导纤维 | |
| C. | 氧化铝可用于冶炼金属铝的原料,也是一种比较好的耐火材料 | |
| D. | 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com