



科目:高中化学 来源: 题型:
| A、标准状况下,2.24L二氧化碳中含有共用电子对的数目为0.2NA |
| B、25℃时,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA |
| C、常温常压下,28g乙烯和丙烯的混合气体中含有碳原子的数目为2NA |
| D、0.1mol Cl2与足量铁粉反应转移电子的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
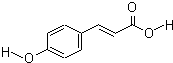 对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛.结构简式如图:
对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛.结构简式如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| 时间/min | CO2(mol/L) | H2(mol/L) | CO(mol/L) | H2O(mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7、K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 |
| B、已知Si3N4、Al2O3熔点很高,一般可以用制作高温结构陶瓷制品 |
| C、乙烯能使溴水褪色、聚乙烯不能使溴水褪色 |
| D、葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com