
 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为2CH3CHO+H2O
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为2CH3CHO+H2O
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:①4OH--4e-====O2↑+2H2O
②
阴极:①
②CH3CHO+2e-+2H2O====CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”“减小”或“不变”)。
(4)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是 。
(5)在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛的含量为3 000 mg·L-1的废水,可得到乙醇 kg(计算结果保留小数点后1位)。
(1)这是关于燃料电池电极的知识,燃料电池中一般还要用到助燃剂,一般为O2(或空气),而氧气就作为电池的正极,加入的燃料比如甲烷之类的就从原电池的负极充入,本题中燃料电池中b极接电解池的阴极,也就是说b极应是燃料电池的负极,所以b极应通入甲烷气体。
(2)这是电解池电极反应式的写法,按照电极放电顺序,可知道这个电解实际上相当于电解水,阳极:①4OH--4e-====O2↑+2H2O,那么阴极:①就是4H++4e-====
2H2↑;阳极:②的电极反应式就必须用总反应2CH3CHO+H2O====CH3CH2OH+CH3COOH减去阴极②CH3CHO-2e-+2H2O====CH3CH2OH+2OH-,但是要注意阴极要换成H+,所以阳极:②的电极反应式为CH3CHO-2e-+H2O====CH3COOH+2H+。
(3)从以上(2)中谈到的这个电解实际上是电解水,所以阴极区Na2SO4的物质的量不变。
(4)题目给出了沸点不同,而且沸点相差比较大,很容易想到利用蒸馏方法分离。
(5)1 m3相当于1 000 L,两极区分别注入1 m3乙醛的含量为3 000 mg·L-1的废水,那么总共注入乙醛的量为2×1 000 L×3 000 mg·L-1=6 000 000 mg=6 000 g=
6 kg,设可得到乙醇mkg,根据方程式计算:
2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
2×44 46
6 kg×60% mkg
解得m≈1.9
答案:(1)CH4
(2)CH3CHO-2e-+H2O====CH3COOH+2H+
4H++4e-====2H2↑或4H2O+4e-====2H2↑+4OH-(写成“2H++2e-====H2↑”也可)
(3)不变 (4)蒸馏 (5)1.9


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
甲、乙、丙三种物质之间有如下转化关系:
甲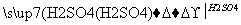 乙
乙 丙
丙 甲
甲
(1)若甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液。
则甲是________,丙是________(填化学式)。写出“乙 丙”转化的离子方程式:______________________________。
丙”转化的离子方程式:______________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲是______,丙是________(填化学式)。写出“甲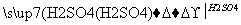 乙”转化的离子方程式:____________________________。
乙”转化的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.将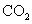 通入
通入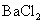 溶液中至饱和,无沉淀产生;再通入
溶液中至饱和,无沉淀产生;再通入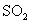 ,产生沉淀
,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入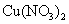 固体,铜粉仍不溶解
固体,铜粉仍不溶解
C.向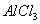 溶液中滴加氨水,产生白色沉淀;再加入过量
溶液中滴加氨水,产生白色沉淀;再加入过量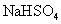 溶液,沉淀消失
溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量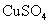 固体,速率不改变
固体,速率不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是( )
A.自来水
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1 CH3COOH溶液
D.0.5 mol·L-1 KCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠或镁的制备。下列关于这三个工业生产的描述中正确的是( )
A.电解法制镁时一般是电解熔融态的氯化镁,但也可用其相应的盐,如熔融态的碳酸镁
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是Cl-失电子
查看答案和解析>>
科目:高中化学 来源: 题型:
2007年10月10日,德国科学家格哈德·埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出的开拓性贡献。合成氨反应在铁催化剂表面进行时效率显著提高,就是埃尔特的研究成果。下列关于合成氨反应的叙述中,正确的是( )
A.铁作催化剂可加快反应速率,且有利于平衡向合成氨的方向移动
B.将氨从混合气中分离,可加快反应速率,且有利于平衡向合成氨的方向移动
C.升高温度可以加快反应速率,且有利于平衡向合成氨的方向移动
D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g)
 2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
下表为不同温度和压强下SO2的转化率(%):
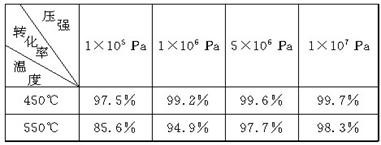
(1)根据化学理论综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是________________________________________________________________________。
(2)实际生产中,选定400℃~500℃作为操作温度,其原因是
________________________________________________________________________。
(1) 实际生产中,采用的压强为常压,其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2) 在生产中,通入过量空气的目的是
________________________________________________________________________
________________________________________________________________________。
(5)尾气中有SO2,必须回收是为了
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B.AgCl的Ksp=1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,[Ag+]=[Cl-]且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2
C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.02 mol·L-1 CH3COOH溶液和0.01 mol·L-1 NaOH溶液以等体积混合,溶液呈酸性,混合溶液中粒子浓度关系正确的是( )
A.[CH3COO-]>[Na+]
B.[CH3COOH]>[CH3COO-]
C.2[H+]=[CH3COO-]-[CH3COOH]
D.[CH3COOH]+[CH3COO-]=0.02 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com