
【题目】关于分散系,下列叙述中正确的是
A.分散系分为胶体和溶液
B.电泳现象可证明胶体带电荷
C.利用丁达尔效应可以区别溶液与胶体
D.按照分散质和分散剂状态不同(固、液、气),它们之间可有6种组合方式
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通过下列工艺流程可制化工业原料H2SO4和清洁能源H2。
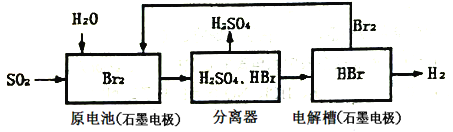
下列说法中错误的是
A. 电解槽中不能用铁电极代替石墨作为阳极
B. 原电池中负极的电极反应为:SO2+2H2O-2e-=SO42-+4H+
C. 该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4
D. 该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )

A. 0-20 s内平均反应速率v(N2O5)="0.1" mol·L-1·s-1
B. 10 s时,正、逆反应速率相等,达到平衡
C. 20 s时,正反应速率大于逆反应速率
D. 曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。实验步骤如下:

①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
(1)A试管中发生反应的化学方程式为__________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_____。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将实验后的溶液分成两份,分别滴加氯水和氨水,均产生白色沉淀。写出其中SO2表现还原性的离子反应方程式为_____。
(4)下列对导管E作用的分析中正确的是__________。
A 加热过程中,可上下移动导管E,起搅拌作用
B 停止加热,试管内的压强减少,从导管E进入的空气可增大试管A内的压强,防止倒吸
C 停止反应,撤装置之前往导管E中通入空气,可排出装置内的SO2气体,防止其污染环境
II ClO2与Cl2的氧化性相近,可用于自来水消毒和果蔬保鲜等方面。某兴趣小组通过图1装置(夹持装置略)对ClO2的制备、除杂、吸收和释放等进行了研究。

(1)仪器B的名称是________。打开B的活塞,A中发生反应为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加B中稀盐酸的速度宜______(填“快”或“慢”)。
(2)关闭B的活塞,ClO2在D中被某种稳定剂完全吸收生成NaClO2,此时F中溶液颜色不变,则装置C的作用是____。
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_____;在ClO2释放实验中,打开E的活塞,D中发生反应,则此时装置F的作用是_____。安装F中导管时,应选用图2中的____(填“a”或“b”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛一铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的价电子排布图为___________。
(2)钒的某种氧化物的晶胞结构如下图1所示,则该氧化物的化学式为___________,其熔沸点比下图3(为邻苯二甲酸酐的结构)物质的熔沸点要___________(填“高”“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯三甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

①五氧化二钒的结构简式如上图2所示,则该结构中含有___________个π键。
②在丙醛( CH3CH2CHO)分子中碳原子的杂化方式分别为___________。
③C、N、O、Ne四元素,其第一电离能从大到小的顺序依次为______________________。
④V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。列举与VO43-空间构型相同的一种阴离子:___________(填离子符号)。
(4)已知单质钒的晶体采用体心立方堆积,晶胞如上图4所示,假设钒原子直径为d×10-7cm,钒的相对原子质量为M,则晶体密度的表达式为___________g·cm-3。(设阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g)![]() pC(g)+qD(g)经10 min后达到平衡,测得此时A的浓度减少了nmol/L,C的浓度增加了2n/3mol/L,又知,平均反应速率VC=2VB.达到平衡后,若保持温度不变,缩小容器体积,A的转化率不变,则该反应的化学方程式应为
pC(g)+qD(g)经10 min后达到平衡,测得此时A的浓度减少了nmol/L,C的浓度增加了2n/3mol/L,又知,平均反应速率VC=2VB.达到平衡后,若保持温度不变,缩小容器体积,A的转化率不变,则该反应的化学方程式应为
A. 2A(g)+6B(g)![]() 3C(g)+5D(g)
3C(g)+5D(g)
B. 3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
C. 3A(g)+B(g)![]() 2C(g)+D(g)
2C(g)+D(g)
D. A(g)+3B(g)![]() 3C(g)+3D(g)
3C(g)+3D(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com