
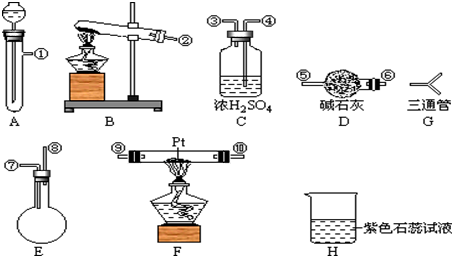
分析 (1)氨气与氧气在催化剂条件下加热生成一氧化氮和水,依据反应条件和反应物状态选择装置;
(2)要快速制备氨气,则应该是将生石灰加入到浓氨水中,据此选择装置及写出方程式;
双氧水在催化剂条件下,不需要加热就会迅速产生大量氧气,据反应物状态和反应条件选择发生装置并写出方程式;
(3)快速制NH3和O2含有水蒸气,所以需要干燥,用碱石灰进行干燥,然后进入F发生成催化氧化,剩余的氨气需要用浓硫酸吸收,同时还要干燥NO,最后检验硝酸的生成,据此连接仪器;
(4)氨气与浓硫酸反应,可以用浓硫酸吸收过量的氨气和气体中的水蒸气;
(5)由于NO2和剩余的氧气溶于水会有硝酸生成,溶液显酸性,因此石蕊试液变为红色.
解答 解:(1)氨气与氧气在催化剂条件下加热生成一氧化氮和水,化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,由于是两种气体之间的反应,所以根据装置的特点可知,应选择装置F制备;
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;F;
(2)要快速制备氨气,则应该是将生石灰加入到浓氨水中,所以选择的装置是A,反应的化学方程式是NH3•H2O=NH3↑+H2O;
双氧水在催化剂条件下,不需要加热就会迅速产生大量氧气,反应物状态为固体与液体,条件不加热,选择装置A;方程式为:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$ 2H2O+O2↑;
故答案为:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;NH3•H2O=NH3↑+H2O;
(3)快速制NH3和O2含有水蒸气,所以需要干燥,用碱石灰进行干燥,然后进入F发生成催化氧化,剩余的氨气需要用浓硫酸吸收,同时还要干燥NO,最后检验硝酸的生成,所以正确的连接顺序是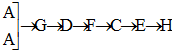 ;
;
故答案为: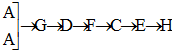 ;
;
(4)C中的浓硫酸用来吸收过来的氨气,干燥气体吸收水蒸气,故答案为:吸收多余NH3和水蒸气;
(5)由于NO2和剩余的氧气溶于水会有硝酸生成,溶液显酸性,因此石蕊试液变为红色,反应的化学方程式是:4NO2+O2+2H2O=4HNO3;
故答案为:4NO2+O2+2H2O=4HNO3.
点评 本题考查气体的制备和性质的检验,熟悉发生装置选择的依据、氨气、氧气的制备原理和性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L硫酸溶液中含有氢离子数目为NA | |
| C. | 标准状况下,22.4LSO3所含有的分子数目为NA | |
| D. | 过氧化钠与水反应时生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
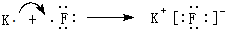
 .
. ,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.
,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②③⑤ | C. | ①②⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 正极材料 | Zn | C | Zn | Mg |
| 负极材料 | Cu | Zn | Ag | Zn |
| 电解质溶液 | CuCl2 | CuSO4 | CuSO4 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑩ | ||||
| 4 | ② | ④ | ⑧ |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 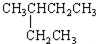 2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. | 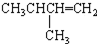 2-甲基丁烯 2-甲基丁烯 | D. | 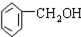 苯甲醇 苯甲醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com