
| A. | 原子半径由小到大的顺序为r(X)<r(Y)<r(Z)<r(W) | |
| B. | X、Y、Z既能形成离子化合物,又能形成共价化合物 | |
| C. | Z分别能与X、Y和W形成多种化合物 | |
| D. | 与单质W比较,单质Z更容易与单质X化合 |
分析 X、Y、Z、W均为短周期主族元素,且原子序数逐渐增大,由①X、Y、W分别位于不同周期,可知X为H,②Z和W属于同一主族,且W的原子序数是Z的两倍,Z为O,W为S;③Y、Z、W的最外层电子数之和为17,Y为第二周期元素,最外层电子数为17-6×2=5,则Y为N元素,然后结合元素周期律来解答.
解答 解:X、Y、Z、W均为短周期主族元素,且原子序数逐渐增大,由①X、Y、W分别位于不同周期,可知X为H,②Z和W属于同一主族,且W的原子序数是Z的两倍,Z为O,W为S;③Y、Z、W的最外层电子数之和为17,Y为第二周期元素,最外层电子数为17-6×2=5,则Y为N元素,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径由小到大的顺序为r(X)<r(Z)<r(Y)<r(W),故A错误;
B.X、Y、Z既能形成离子化合物,又能形成共价化合物为硝酸铵,故B正确;
C.Z分别能与X、Y和W形成多种化合物,为水、过氧化氢,NO、二氧化氮等,二氧化硫、三氧化硫,故C正确;
D.非金属性O>S,则与单质W比较,单质Z更容易与单质X化合,故D正确;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子结构推断元素为解答的关键,侧重分析与推断能力的考查,注意周期律的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
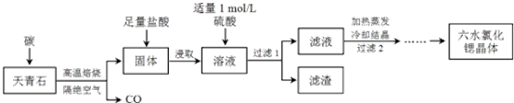
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠的电子式: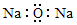 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: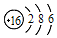 | |
| D. | CCl4的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 该反应为吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{c(C)•c(D)}{c(A)•c(B)}$ | |
| C. | 其他条件不变时,增大体系的压强,化学平衡常数减小 | |
| D. | 单位时间内生成B和D的物质的量相等时,该反应处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 | B. | 3mol•L-1 | C. | 2mol•L-1 | D. | 4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下的平衡常数是:K=$\frac{9}{16}$ | |
| B. | 达到平衡时,NO的转化率是60% | |
| C. | 3min末达到平衡,则v(NO)=0.01mol/(L•min) | |
| D. | 升高温度有利于活性炭处理更多的污染物NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | W | |
| 起始状态(mol) | 2 | 1 | 0 |
| 平衡状态(mol) | 1 | 0.5 | 1.5 |
| A. | 该温度下,该反应的平衡常数K=9 | |
| B. | 升高温度,若W的体积分数减小,此反应△H>0 | |
| C. | 该温度下,该反应的方程式为 2X(g)+Y(g)?3W(g) | |
| D. | 增大压强,正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
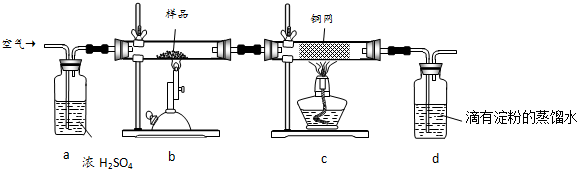

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com