ij��ȤС��Ϊ��֤�ճ������õĻ��ͷ�Ϻ���KclO
3��MnO
2��S���������ͼ1ʵ�����̣�
��ش��������⣺
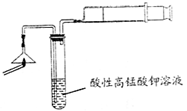
��1��Ϊ��֤����A����ͼ2����ʾ����ʵ�飺���ܹ۲쵽
KMnO4��Һ���Ϻ�ɫ����ɫ
KMnO4��Һ���Ϻ�ɫ����ɫ
��������֤�����ͷ�Ϻ���SԪ�أ�
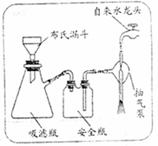
��2������ڵ�ʵ�����װ����2����ʾ���ò�����������
��ѹ����
��ѹ����
���乤��ԭ����
���ҿ�����ˮ��ͷ��װ���ڲ��Ŀ���������ˮ�����ߣ�����װ���ڲ�ѹǿ��С��ʹ�����ٶȼӿ죬�õ��ϸ���Ĺ�������
���ҿ�����ˮ��ͷ��װ���ڲ��Ŀ���������ˮ�����ߣ�����װ���ڲ�ѹǿ��С��ʹ�����ٶȼӿ죬�õ��ϸ���Ĺ�������
��
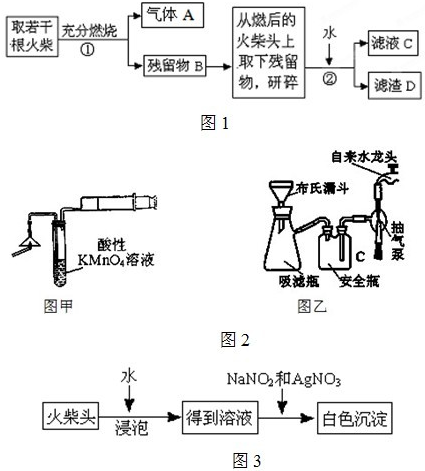
��3��Ҫ֤�����ͷ�к���ClԪ�صĺ���ʵ�鲽����
ȡ��ҺC������HNO3��AgNO3��Һ�����۲쵽��ɫ��������������֤�����ͷ�к�����Ԫ��
ȡ��ҺC������HNO3��AgNO3��Һ�����۲쵽��ɫ��������������֤�����ͷ�к�����Ԫ��
��
��4����ѧ�����������ͷ��KClO
3��һ��ʵ�鷽������ͼ3�����йص����ӷ�Ӧ����ʽΪ
ClO3?+3NO2?+Ag+=AgCl��+3NO3?
ClO3?+3NO2?+Ag+=AgCl��+3NO3?
������������������г��ְ�ɫ���������ܳ��˵�����ͷ��KClO
3�Ĵ��ڣ���������
AgNO2��AgCl��Ϊ������ˮ�İ�ɫ����
AgNO2��AgCl��Ϊ������ˮ�İ�ɫ����
��
��5����С��²�����D��˫��ˮ�ֽ������������ʻ����һ����Ӱ�죬��Ʋ�����������5��ʵ�飮
| ʵ����� |
H2O2��Һ��������% |
H2O2��Һ����/���� |
����D����/�� |
��Ӧ�¶�/�� |
�ռ��������/���� |
����ʱ��/�� |
| �� |
30 |
5 |
0 |
85 |
2 |
3.8 |
| �� |
15 |
2 |
0.1 |
20 |
2 |
2.8 |
| �� |
15 |
2 |
0.2 |
20 |
2 |
2.2 |
| �� |
5 |
2 |
0.1 |
20 |
2 |
7.4 |
| �� |
30 |
5 |
0 |
55 |
2 |
10.5 |
���ϱ���֪��ʵ��ٺ͢���֤���¶�Խ�ߣ���ѧ��Ӧ����Խ�죬ʵ��
��
��
��
��
��
֤������D������Խ��Ӧ����Խ�죮
��6��д��������з�����Ӧ�Ļ�ѧ����ʽ
��