
| A、pH相等的①NH4Cl ②(NH4) 2SO4③NH4HSO4的溶液中,c(NH4+)大小:①>②>③ |
| B、向1.00L0.3mol?L-l的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中:3c (Na+)=2[c(HCO3-)+C (CO32-)+c(H2CO3)] |
| C、浓度均为0.1 mol?L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c (CH3COOH)=c (H+)-c(OH-) |
| D、常温下,在l0mL pH=12的氢氧化钠溶液中加入pH=2的HA酸至pH刚好等于7,所得溶液体积V(总)≤20mL |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )| A、能与FeCl3溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、1mol该物质与足量钠发生反应生成4molH2 |
| D、1mol该物质最多可与1molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
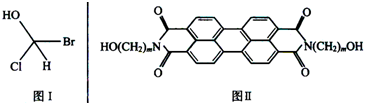
查看答案和解析>>
科目:高中化学 来源: 题型:
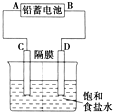 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4查看答案和解析>>
科目:高中化学 来源: 题型:
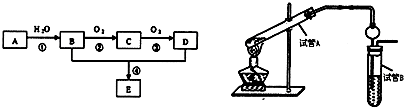
| 光照 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com