
【题目】X、Y、Z三种物质中含同种元素,在一定条件下可以实现如图所示转化:
下列推断不正确的是

A.若Y为氧化铝,则Y 生成X的条件是“通电”
B.若X为硫单质,则Y 可能为硫化氢
C.若Z为硝酸,则X可能为一氧化氮
D.若Z为硝酸铁,则Y一定为铁单质
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol·L-1 NaOH溶液480 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度 ________(填“>”、“<”或“=”)0.3 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“ >”、“<”或“=”)0.3 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm- 3的浓硫酸的体积为 ________ mL (计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】暗红色固体X由三种常见的元素组成(式量为412),不溶于水,微热易分解,高温爆炸。
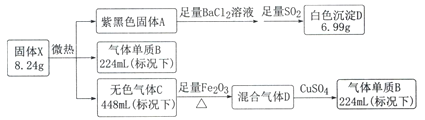
己知:气体B在标准状况下的密度为1.25g.L-1,混合气体通过CuSO4,CuSO4固体变为蓝色。
请回答以下问题:
(1)写出A的电子式____________。
(2)写出生成白色沉淀D的化学方程式________________________。
(3)固体X可由A与过量气体C的浓溶液反应生成,其离子方程式为_________________
(4)有人提出气体C在加热条件下与Fe2O3反应,经研究固体产物中不含+3价的铁元素,请设计实验方案检验固体产物中可能的成分(限用化学方法)________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对人类生存具有重大意义,反应为:N2(g)+3H2(g)![]() 2NH3(g) H
2NH3(g) H
(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
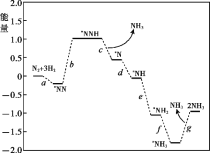
① NH3的电子式是_______。
② 写出步骤c的化学方程式_______。
③ 由图像可知合成氨反应的H______0(填“>”、“<”或“=”)。
(2)传统合成氨工艺是将N2和H2在高温、高压条件下发生反应。若向容积为1.0 L的反应容器中投入5 mol N2、15 mol H2,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:

① 温度T1、T2、T3大小关系是_______。
② M点的平衡常数 K = _______(可用分数表示)。
(3)目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如下:
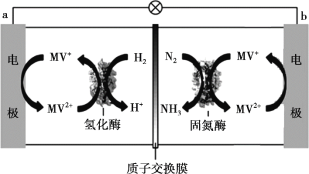
① 导线中电子移动方向是_______。
② 固氮酶区域发生反应的离子方程式是_______。
③ 相比传统工业合成氨,该方法的优点有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,装置正确且设计合理的是
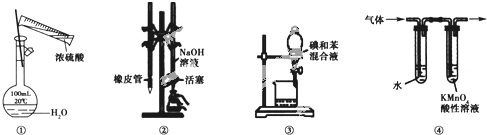
A.图![]() 所示装置进行浓硫酸稀释配制稀硫酸的实验
所示装置进行浓硫酸稀释配制稀硫酸的实验
B.图![]() 所示装置进行用已知浓度为NaOH溶液测定盐酸浓度的实验
所示装置进行用已知浓度为NaOH溶液测定盐酸浓度的实验
C.图![]() 所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口倒出
所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口倒出
D.图![]() 所示装置可检验溴乙烷发生消去反应得到的气体中含有乙烯
所示装置可检验溴乙烷发生消去反应得到的气体中含有乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中一定会造成误差的是
A.将pH试纸用蒸馏水湿润后测某溶液的pH
B.在中和热的测定实验中用![]() 代替NaOH;
代替NaOH;![]() 代替HCl
代替HCl
C.用碱石灰来干燥氨气
D.使用托盘天平称量时将药品放在天平的右盘与砝码放在天平的左盘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的装置和其他必要的仪器用品,完成下列实验。
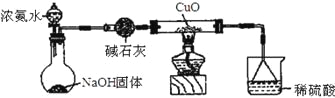
已知2NH3+3CuO![]() N2+3Cu+3H2O,该实验证明氨气具有还原性。
N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是______________,倒扣漏斗的作用是___________________。
(2)浓氨水与固体NaOH接触,会逸出大量氨气原因是______________________。
(3)硬质玻璃管中可观察到的实验现象是_________________________________。
(4)常温下,若氨水与稀硫酸恰好完全中和,则所得溶液中各离子浓度的大小顺序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氯碱工业的简易装置示意图,其中两电极均为惰性电极。下列说法正确的是
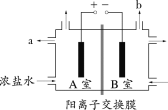
A.粗盐水中含有的少量Ca2+和Mg2+可用NaOH除去
B.适当降低阳极电解液的pH有利于Cl2逸出
C.a处得到的是浓NaOH溶液
D.若电路中通过0.2mol电子,理论上可在b处得到标准状况下1.12L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com