
| A. | 乙炔分子的球棍模型: | B. | 羟基的电子式: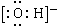 | ||
| C. | 2氯丙烷的结构简式:CH3CHClCH3 | D. | 丙烯的键线式: |
分析 A.乙炔是直线形分子,碳碳原子之间存在三键;
B.羟基结构简式为-0H,为中性原子团,据此书写电子式;
C.主链上有3个碳原子,在2号碳原子上有一个氯原子;
D.键线式是以短线代替碳碳共价键,分子中的碳氢键、碳原子及与碳原子相连的氢原子均省略,其它杂原子及与杂原子相连的氢原子须保留,交点和端点表示碳原子,由H原子来饱和使碳达到4价结构.
解答 解:A.乙炔是直线形分子,碳碳原子之间存在三键,所以其球棍模型: ,故A错误;
,故A错误;
B.氧原子与氢原子通过一对共用电子对连接,羟基中的氧原子含有一个未成对电子,电子式为: ,故B错误;
,故B错误;
C. 2-氯丙烷,主链上有3个碳原子,在2号碳原子上有一个氯原子,结构简式:CH3CHClCH3,故C正确;
D.丙烯的结构式为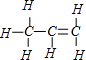 ,故其键线式为
,故其键线式为 ,故D错误.
,故D错误.
故选:C.
点评 本题考查了球棍模型、电子式、结构简式、键线式的书写,明确电子式、结构简式、键线式的书写规则即可解答,易错选项是B,注意羟基结构简式为-0H,为中性原子团,为易错点,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 元素的最高化合价均为+7 | |
| C. | 从上到下原子半径递增 | |
| D. | 从上到下非金属性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
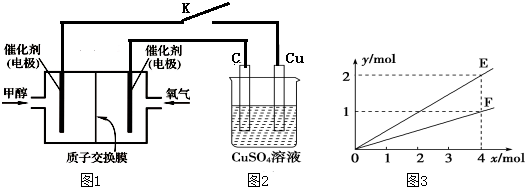
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| B. | 1.4g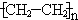 中含有的碳原子数为0.2NA 中含有的碳原子数为0.2NA | |
| C. | 1 mol苯分子中含有C=C双键数为3NA | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成水分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、Cl-、HCO3- | B. | Ba2+、Na+、SO42-、Cl- | ||
| C. | MnO4-、K+、S2-、H+ | D. | Mg2+、Cl-、NO${\;}_{3}^{-}$、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
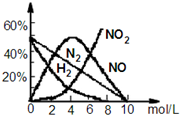 HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:
HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
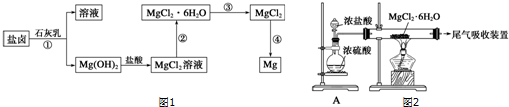
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com