
(10分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓)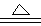 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)浓H2SO4作_________剂,具有 性,氧化产物是 (写化学式)。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,还原了 mol H2SO4,生成 L SO2(标准状况)气体。
(3)Cu与SO2的还原性由强到弱的顺序为:Cu SO2(填“>”、“<”或“=”)。
(10分)(1)氧化,氧化,CuSO4 (每空1分)
(2)1 0.5 11.2 (每空2分) (3)> (1分)
解析试题分析:(1)硫酸中S元素的化合价从+6价降低到+4价,得到2个电子,所以硫酸是氧化剂,具有氧化性。铜的化合价从0价升高到+2价,失去2个电子,作还原剂,所以氧化产物就是硫酸铜。
(2)32g的物质的量是32g÷64g/mol=0.5mol,则失去0.5mol×2=1.0mol电子;根据电子的得失守恒可知,被还原的硫酸的物质的量是1.0mol÷2=0.5mol,所以生成的SO2就是0.5mol,所以在标准状况下的体积是0.5mol×22.4L/mol=11.2L。
(3)由于在氧化还原反应中,还原剂的还原性强于还原产物的,所以铜的还原性强于SO2的。
考点:考查氧化还原反应的有关判断、计算和应用
点评:该题是高考中的常见题型,本题难度不大,试题基础性强,学生不难得分。该题的关键是理解有关的概念,其次要准确标出有关元素的化合价变化情况,然后依据有关的概念灵活分析、判断即可。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2011-2012年北京市重点中学高一上学期期中考试化学试卷 题型:填空题
(6分)铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作________
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作________ _剂,具有 性。在该反应中,若消耗了32 g Cu,则转移了_______mol 电子,生成 L SO2(标准状况)气体。
_剂,具有 性。在该反应中,若消耗了32 g Cu,则转移了_______mol 电子,生成 L SO2(标准状况)气体。
查看答案和解析>>
科目:高中化学 来源:2015届广东省陆丰市高一第四次月考化学试卷(解析版) 题型:填空题
(10分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓)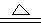 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)浓H2SO4作_________剂,具有 性,氧化产物是 (写化学式)。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,还原了 mol H2SO4,生成 L SO2(标准状况)气体。
(3)Cu与SO2的还原性由强到弱的顺序为:Cu SO2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012年北京市高一上学期期中考试化学试卷 题型:填空题
(6分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生
反应;浓H2SO4作_________剂,具有
性。在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,生成
L SO2(标准状况)气体。
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生
反应;浓H2SO4作_________剂,具有
性。在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,生成
L SO2(标准状况)气体。
查看答案和解析>>
科目:高中化学 来源:2014届广东省高一上学期期末考试化学试卷 题型:填空题
(7分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)浓H2SO4作_________剂,具有 性。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,还原了 mol H2SO4,生成 L SO2(标准状况)气体。
(3)以下三种物质的氧化性由强到弱的顺序为: (写出序号)
① 浓H2SO4 ②稀H2SO4 ③CuSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com