
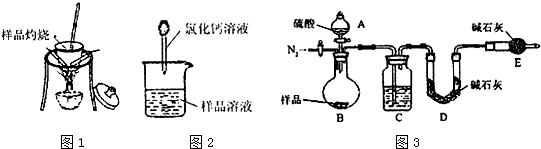
分析 方案一:该方案原理为在加热的条件下Na2CO3能够稳定存在,而NaHCO3较易发生如下的分解反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,从而根据残留的固体的量推算出样品中碳酸钠的质量分数,要加热至恒重,以保证NaHCO3全部分解.
方案二:该方案原理为在样品中加入CaCl2溶液,其中Na2CO3可与CaCl2发生反应Na2CO3+CaCl2=CaCO3↓+2NaCl,而NaHCO3与CaCl2则不反应,从而根据产生的沉淀量,得出纯碱的质量分数;
方案关键是测定CaCO3沉淀的质量,自然要保证沉淀完全,要正确过滤好;
(3)沉淀会附着氯化钠、氯化钙等,需要洗涤除去;
(4)根据碳酸钙计算碳酸钠质量,再根据质量分数定义计算碳酸钠质量分数.
(5)在一定量样品中加入足量Ca(OH)2溶液,此时分别发生如下反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均产生CaCO3沉淀,根据样品的总量和生成CaCO3沉淀的量,就可得出纯碱的质量分数;
方案三:该方案原理为一定量混合样品与足量的稀硫酸分别发生如下反应Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,
2 NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O↑,根据所产生的CO2的质量,可以分别求得样品中Na2CO3和NaHCO3的质量从而得出纯碱的质量分数.该方案关键是要获得产生的CO2的质量,在实验前要检查装置的气密性,要将装置中的CO2全部被碱石灰所吸收,要称量碱石灰在吸收CO2前后的质量;
(6)C装置干燥二氧化碳;
(7)实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差.
解答 解:(1)样品中的碳酸氢钠受热分解生成碳酸钠、水、二氧化碳,化学方程式是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O;
(2)加热到固体为恒重时,说明碳酸氢钠分解完全,所以重复“加热一冷却一称量”操作多次的目的是:确保碳酸氢钠完全分解,减少测定误差,
故答案为:确保碳酸氢钠完全分解,减少测定误差;
(3)氯化钙与碳酸钠反应生成碳酸钙沉淀,利用碳酸钙的质量测定碳酸钠的质量分数,所以将碳酸钙沉淀过滤后的操作为洗涤沉淀,再干燥、称量,
故答案为:洗涤;
(4)沉淀经干燥后称量为m2g,说明碳酸钙的物质的量是$\frac{{m}_{2}}{100}$mol,则碳酸钠的质量是$\frac{{m}_{2}}{100}$mol×106g/mol=$\frac{53{m}_{2}}{50}$g,所以碳酸钠的质量分数是:$\frac{\frac{53{m}_{2}}{50}g}{{m}_{1}g}$=$\frac{53{m}_{2}}{50{m}_{1}}$,
故答案为:$\frac{53{m}_{2}}{50{m}_{1}}$;
(5)若用氢氧化钙代替氯化钙,则氢氧化钙会与碳酸氢钠反应生成碳酸钙沉淀,则沉淀的质量增加,所以碳酸钠的质量偏大,结果偏高,
故答案为:偏高;
(6)方案三是利用与足量的酸反应生成二氧化碳气体的质量计算碳酸钠的质量分数,则C装置内的液体起干燥作用,所以C中液体为浓硫酸,
故答案为:浓硫酸;
(7)反应前通入氮气是排除装置内的二氧化碳、水蒸气,反应后通入氮气的目的是将装置内的二氧化碳尽可能驱入装置D中,减小实验误差,
故答案为:将B、C装置中的CO2全部驱入D装置的碱石灰中,减小实验误差.
点评 本题以“实验探究工业纯碱中碳酸钠的质量分数”为载体,考查学生对于实验原理与装置理解评价、实验基本操作、化学计算等,难度中等,题目涉及到的小苏打和纯碱的化学知识是多方面的,构成了一道多角度的探究题.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物可能含有非极性键 | |
| B. | X的单质与Z的单质在暗处能剧烈反应 | |
| C. | 含W的盐溶于水形成的溶液一定显酸性 | |
| D. | 离子半径:r(Z-)>r(W3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.4 mo l•L-1 NaOH溶液 | B. | 5 mL 0.3 mo l•L-1 Na3PO4溶液 | ||
| C. | 10 mL 0.3 mo l•L-1 Na2SO4溶液 | D. | 5 mL 0.5 mol•L-1 NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知X、Y是两种性质相似的短周期元素.
已知X、Y是两种性质相似的短周期元素.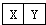 ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存, .(2)Y元素在周期表中位置第三周期ⅢA族.
.(2)Y元素在周期表中位置第三周期ⅢA族. ,X是形成化合物种类最多的元素.
,X是形成化合物种类最多的元素. ,X、Y的最高价含氧酸的浓溶液都有强氧化性.
,X、Y的最高价含氧酸的浓溶液都有强氧化性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com