
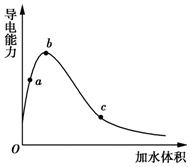
 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )| A. | a、b、c三点溶液的pH:c<a<b | |
| B. | 用湿润的pH试纸测量a处溶液的pH,测量结果偏小 | |
| C. | a、b、c三点CH3COOH的电离程度:c<a<b | |
| D. | a、b、c三点溶液用1 mol•L-1 NaOH溶液中和,消耗NaOH溶液体积:c<a<b |
分析 A.导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
B.a处溶液稀释时,溶液酸性增强;
C.随水的增多,醋酸的电离程度在增大;
D.a、b、c三点溶液浓度不同,但溶质的物质的量相同.
解答 解:A.导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<a<c,故A错误;
B.用湿润的pH试纸测量酸性的pH,a处溶液溶液稀释,导电能力增大,溶液酸性增强,pH减小,所以测量结果偏小,故B正确;
C.随水的增多,醋酸的电离程度在增大,所以a、b、c三点醋酸的电离程度:a<b<c,故C错误;
D.a、b、c三点溶液浓度不同,但溶质的物质的量相同,所以a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a=b=c,故D错误;
故选B.
点评 本题考查电解质的电离,题目难度中等,本题注意分析图象,把握弱电解质的电离特征,易错点为C,注意氢离子浓度越大,其溶液的pH越小.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1醋酸溶液中含有醋酸分子的数目为0.1NA | |
| B. | 25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.2 NA | |
| C. | 常温下,20 L pH=12的Na2CO3溶液中含有OH-数目为0.2 NA | |
| D. | 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子数目为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
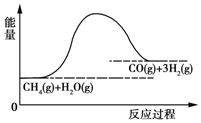 合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )
合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )| A. | △H<0,△S<0 | B. | △H>0,△S<0 | C. | △H<0,△S>0 | D. | △H>0,△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | M点的正反应速率小于W点的逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
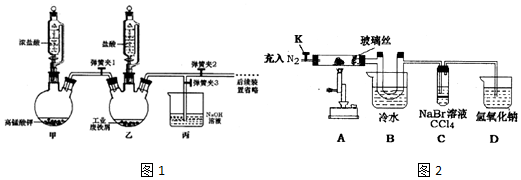
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因排出装置内的空气 |
| 关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因FeC13易升华 |
| 实验结束,振荡C静置 | ③溶液分层,上层接近无色,下层橙红色 | ④2FeC13$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-(用相关的方程式说明) |
| ⑤结合以上实验和文献资料,该固体可以确定的成分有FeC13、Fe2O3. | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子直径大于100nm | |
| B. | 丁达尔效应可以用于检验胶体 | |
| C. | 将FeCl3溶液滴加到氢氧化钠溶液中即可制得氢氧化铁胶体 | |
| D. | 分离胶体和溶液可以采用过滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 混合气体通过盛有足量溴水的洗气瓶 | |
| C. | 混合气体通过盛水的洗气瓶 | |
| D. | 混合气体与氢气混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com