
����Ŀ������β���к���CO��NO���к�������

��1������β����NO���ɹ��̵������仯ʾ��ͼ��ͼ���������£�1molN2��1molO2��ȫ��Ӧ����NO��_______________�����������������ų�����___________kJ������
��2��ͨ��NO�������ɼ������β����NO�ĺ������乤��ԭ����ͼ��ʾ��
��NiO�缫�Ϸ�������___________��Ӧ������������������ԭ������
�����·�У��������������Ǵ�_________�缫����_______�缫������NiO������Pt������
��Pt�缫�ϵĵ缫��ӦʽΪ_______________________________��
��3��һ�����ʹ�����ʹNO��CO������Ӧ��2NO+2CO![]() 2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±�����
2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±�����
ʵ���� | t������ | NO��ʼŨ�� | CO��ʼŨ�ȣ�mol/L�� | �����ıȱ������m2/g�� |
�� | 280 | 1.2��10��3 | 5.80��10��3 | 82 |
�� | 280 | 1.2��10��3 | b | 124 |
�� | 350 | a | 5.80��10��3 | 82 |
����������ݲ���������a___________��b____________��
������֤�¶ȶԻ�ѧ��Ӧ���ʹ��ɵ���ʵ��____________________����ʵ����ţ���
��ʵ������ʵ�����У�NO�����ʵ���Ũ��c��NO����ʱ��t�ı仯������ͼ��ʾ�����б�ʾʵ������������________________����������������������
���𰸡� ���� 180 ���� NiO Pt O2+4e��=2O2�� a 1.2��10��3 b ��5.80��10��3 ��͢� ��
��������(1)N2(g)+O2(g)=2NO(g)����Ӧ��=��Ӧ��ϼ����յ�����-�������γ��ͷų����������÷�Ӧ�ķ�Ӧ��=(946+498)kJ/mol-2��632kJ/mol=+180kJ/mol��
��������һ�����ȷ�Ӧ��1molN2��1molO2��ȫ��Ӧ����NO������180kJ��������
(2)����ͼ֪����ӵ�Դ������һ�����װ�ã���O2-���˶������жϳ�NiO�缫��������������NOʧ���Ӻ������ӷ�Ӧ���ɶ�������������������Ӧ�����缫�������������õ����ӣ�������ԭ��Ӧ��
��NiO�缫��NOʧ���Ӻ������ӷ�Ӧ���ɶ�������������������Ӧ��
�������·�У����Ӵ�����(NiO)�����·������(Pt)��
��pt�缫���������õ����ӱ���ԭ�������ӣ����ӷ���ʽΪ��O2+4e-=2O2-��
(3)����֤�¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬�¶�Ҫ��ͬ������������ͬ������a=1.2��10-3����֤�����ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ�죬Ҫ�����ıȱ������ͬ������������ͬ��b=5.80��10-3��
����֤�¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬ֻ��ʵ���͢���¶Ȳ�ͬ����������Ҫ��ͬ��
�۴����ıȱ������Ӧ���ʿ죬��ƽ���ʱ��̣������ҵ�б�ʴ�Ӧ�졣


 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з������ʵķ���������������С���з������( )
A. ��Һ B. ���� C. ���� D. �ؽᾧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧʵ����ȤС����������ͼ��ʾ��ʵ��װ���Ʊ�Cl2��ͬʱ�����������йص�ijЩʵ�飬��Ҫ��ش����⡣
��1��A��Ũ���ᣬB�Ƕ������̣���A����B��ʱ������Ӧ�����ӷ���ʽΪ___________
��2����ͬѧ�ú���0.2 mol HCl��Ũ������������MnO2��Ӧ��Cl2������Ƶõ�Cl2���(��״����)С��1.12 L���������ڷ�Ӧ����������Ũ�ȱ�С��ɵġ����оٵ�������Ũ�ȱ�С��ԭ��_____________________��
��3����ʵ�����У���ͬѧ������ͼ�е�װ�þ�����������ƿ�٢���Ӧʢ�ŵ��Լ��ֱ��Ǣ�________________����_______________(���Լ�����)��

��4����ͬѧ��������Cl2ͨ��һ����ʯ����������ȡƯ�ۣ���ͨ��224 mL(��״����)Cl2��ȫ��Ӧ����Ӧ������ת�Ƶ��ӵ����ʵ���Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2 mol A��2 mol B�����2 L���ܱ������У�������Ӧ��2A��g����3B��g�� ![]() 2C��g����zD��g������2 s��A��ת����Ϊ50%�����v��D����0.25 mol��L��1��s��1�������ƶ���ȷ����
2C��g����zD��g������2 s��A��ת����Ϊ50%�����v��D����0.25 mol��L��1��s��1�������ƶ���ȷ����
A��v��C����0.2 mol��L��1��s��1
B��z��3
C��B��ת����Ϊ25%
D��Cƽ��ʱ��Ũ��Ϊ0.5 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǹ�ũҵ�����в��ɻ�ȱ�����ʣ��о���ȡ�����Ļ�������Ƿ���
��1���ڳ��¡���ѹ�����������£�N2�ڲ�������Fe2O3��TiO2����������ˮ�������з�Ӧ:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) ��H=a kJ mol-1 ��
O2(g) ��H=a kJ mol-1 ��
Ϊ��һ���о�����NH3�����ʵ������¶ȵĹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������£�
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
�˷�Ӧ��a_________0����S________0�����>����<���� = ����
��2�������¶Ⱥ�ѹǿ�£���2 L�ĺ����ܱ������кϳɰ���:N2(g)+3H2(g)![]() 2NH3(g) ��H=-92.4 kJ mol-1���ڷ�Ӧ�����з�Ӧ�������������ʵ�����ʱ��ı仯��ͼ��ʾ��
2NH3(g) ��H=-92.4 kJ mol-1���ڷ�Ӧ�����з�Ӧ�������������ʵ�����ʱ��ı仯��ͼ��ʾ��
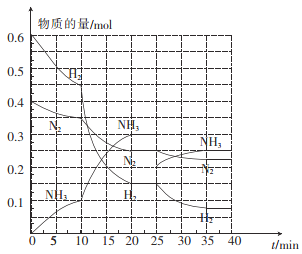
�� 0��10 min�ڣ���NH3��ʾ��ƽ����Ӧ����Ϊ_________��
�� ��10��20 min�ڣ�NH3Ũ�ȱ仯��ԭ�������_______��
A��������� B����С������� C�������¶� D������NH3�����ʵ���
�� �ڷ�Ӧ������25 minʱ�����߷����仯��ԭ����____________���ﵽ�ڶ���ƽ��ʱ����ƽ���ƽ�ⳣ��K2______K1���>����<���� = ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��D��E��F��G��H��I��J�����ڱ��е�λ�����£�

��Ҫ��ش��������⡣
��1���ϱ�Ԫ���У��γ���̬�⻯�����ȶ�����____Ԫ�أ���Ԫ�ط��ţ���
��2��32Ge��Bͬ�壬32Ge����۵����������������Ʒ�Ӧ�Ļ�ѧ����ʽΪ
_______________________________________________________________��
��3���ȵ��ӵ�D��F��G��H����Ԫ���γɵ����ӣ����Ӱ뾶�ɴ�С��˳���ǣ������ӷ��ţ�
_____���� ������ ������ ����
��4��D��IԪ���γɵ��⻯���У��е�ϸߵ���_____________������__________________��
��5��34Se�ǽ����Ա�D______������ǿ����������������ԭ�ӽṹ�ĽǶȽ�����ԭ��Ϊ______________��
��6���õ���ʽ��ʾE��G�γɻ�����Ĺ���_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��ֱ���������ʼ���ˮ�У���ʹˮ�ĵ���̶�������������Һ�����Ե���
A. K2SO4 B. NaHSO4 C. NaClO D. NH4NO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��WΪ���ֶ�����Ԫ�ء�Xԭ�ӵ�����������Ӳ�����ͬ��Wԭ�Ӻ����������Mԭ��������������2����Y��Z��M��W�����ڱ��е����λ����ͼ��ʾ������˵������ȷ����
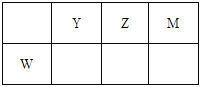
A. ԭ�Ӱ뾶��W>Y>Z>M>X
B. ���ȶ��ԣ�XM>X2Z���е㣺X2Z>YX3
C. X��Y��Z����Ԫ���γɵĻ������в����ܺ����Ӽ�
D. ZM2��YM3��WM4������ÿ��ԭ������������8���ӽṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����Һ�п��Է�����Ӧ��X��2Y3��==2Y2����X2�����������������ж���ȷ����( )
��X������ ��X�������� ��X���л�ԭ�� ��Y2������������
��Y2�����л�ԭ�� ��Y3���������Ա�X2����������ǿ
A���ڢۢܢ� B���٢ۢܢ� C���٢ۢݢ� D���٢ڢݢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com