
【题目】有机高分子材料M的结构简式为 ,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。

已知:①A分子中有两种不同环境的氢原子
②CH3CH2CH![]() CH2
CH2![]() CH3CHBrCH
CH3CHBrCH![]() CH2
CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH
CH3CH![]() CHCHO+H2O
CHCHO+H2O
请回答以下问题:
(1)A的结构简式为____,B的名称为____,F中所含官能团的名称是__________。
(2)①和③的反应类型分别是____、____;反应②的反应条件为_____________。
(3)反应④的化学方程式为_____________________________________________。
(4)有机物E有多种同分异构体,其中同时符合下列条件的同分异构体有___种。
①属于芳香酯类 ②其酸性水解产物遇FeCl3显紫色
(5)以1-丙醇和NBS为原料可以制备聚丙烯醇(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
A![]() B……
B……![]() 目标产物
目标产物
【答案】![]() 环戊烯 碳碳双键、羧基 消去 加成 氢氧化钠水溶液、加热
环戊烯 碳碳双键、羧基 消去 加成 氢氧化钠水溶液、加热 ![]() 13
13 
【解析】
本题考查有机物的合成和推断,主要从官能团的性质入手,根据信息①,A分子中有两种不同环境的氢原子,且A和氢气发生加成反应,因此A的结构简式为![]() ,B与C在NBS根据信息②B与C发生取代,B含有碳碳双键,则反应①发生消去反应,B的结构简式为
,B与C在NBS根据信息②B与C发生取代,B含有碳碳双键,则反应①发生消去反应,B的结构简式为![]() ,根据反应②得到产物羟基的位置,C中溴原子的位置应在羟基的位置,即C的结构简式为
,根据反应②得到产物羟基的位置,C中溴原子的位置应在羟基的位置,即C的结构简式为![]() ,反应②在碱的水溶液中发生取代反应,根据反应信息,以及E的产物,推出E的结构简式为:
,反应②在碱的水溶液中发生取代反应,根据反应信息,以及E的产物,推出E的结构简式为: ,D的结构简式为:CH3CHO,生成F,发生醛基的氧化成,则F的结构简式为
,D的结构简式为:CH3CHO,生成F,发生醛基的氧化成,则F的结构简式为 ,反应④发生酯化反应,据此答题。
,反应④发生酯化反应,据此答题。
(1)根据上述分析,A的结构简式为![]() ,根据B的结构简式,以及有机物命名原则,即B为环戊烯,根据F的结构简式,含有官能团是碳碳双键和羧基;故答案为:
,根据B的结构简式,以及有机物命名原则,即B为环戊烯,根据F的结构简式,含有官能团是碳碳双键和羧基;故答案为:![]() ;环戊烯;碳碳双键、羧基。
;环戊烯;碳碳双键、羧基。
(2)根据上述分析,发生反应类型是消去反应、加成反应;反应②发生取代反应,条件是氢氧化钠的水溶液,并加热;故答案为:消去、加成;氢氧化钠水溶液、加热。
(3)反应④发生酯化反应,其反应方程式为:
![]() ;故答案为:
;故答案为: ![]() 。
。
(4)①属于芳香酯,含有酯基,②水解后遇FeCl3发生显色反应,说明含有酚羟基, (苯环上甲基有3种位置)、
(苯环上甲基有3种位置)、 (苯环上乙基有3种位置)、
(苯环上乙基有3种位置)、 (另一个甲基有4种位置)、
(另一个甲基有4种位置)、 (另一个甲基位置有2种)、
(另一个甲基位置有2种)、 (另一个甲基只有一种位置),共有13种;故答案为:13。
(另一个甲基只有一种位置),共有13种;故答案为:13。
(5)此高分子化合物单体为CH2=CHCH2OH,1-丙醇先发生消去反应,生成CH2=CHCH3,根据信息,在NBS发生取代反应,生成CH2=CHCH2Br,然后发生水解,即路线图: ,故答案为:
,故答案为: 。
。


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】1.76g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2气体1792mL(标准状况),向反应后的溶液中加入适量的1.0 mol/LNaOH溶液,恰好使溶液中的金属离子全部沉淀。下列说法不正确的是
A. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
B. 浓硝酸在反应中表现了氧化性和酸性,且表现氧化性的硝酸的物质的量为0.08 mol
C. 得到沉淀的质量为3.12g
D. 加入NaOH溶液的体积是50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:
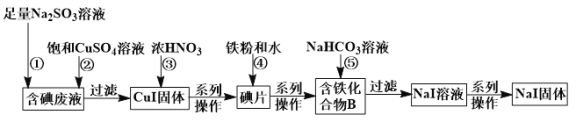
已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO 合成甲醇的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A. 温度:T1>T2>T3 B. 正反应速率:v(a)>v(c),v(b)>v(d)
C. 平衡常数:K(a)>K(c)>K(b)>K(d) D. 平均摩尔质量:M(a)>M(c),M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种 浓度之和的分数)与pH的关系分别如图所示。

①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 _____________________。 ②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1 = -lg Ka1 )。
(5)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应的ΔH________0(填“>”或“<”)。

图表示CO的平衡转化率与起始投料比、温度的变化关系,测得B(x1,60)点氢气的转化率为40%,则x1=__________。
②一定条件下,将2 mol CO和2 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 用氨水吸收少量SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B. 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C. FeO和稀HNO3的反应:FeO+2H+=Fe2++H2O
D. 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的
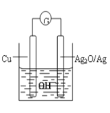
A.Cu为正极,Ag2O为负极
B.电池工作时,OH—向正极移动
C.正极的电极反应为:2Cu+2OH——2e—=Cu2O+H2O
D.外电路中每通过2mol电子,正极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈尔滨医科大学附属第一医院张亭栋教授被认为最有可能获诺贝尔生理学或医学奖的学者之一,他是使用砒霜(As2O3)治疗白血病的奠基人,回答下列问题:
(1)基态As原子核外电子排布中能级最高的是___________,与As同周期且相邻原子的第一电离能由大到小的顺序为___________。
(2)NH3的沸点比PH3___________(填“高”或“低”),原因是___________。
(3)NH5中所有原子最外层都满足稳定结构,则NH5中含有的化学键类型为___________。
A、离子键 B、配位键 C、共价键 D、氢键 E、σ键 F、π键
(4)As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。与AsO43-互为等电子体的微粒是___________(写一种)

(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小黑点表示白磷分子),已知晶胞的边长为anm,阿伏加德罗常数为 NAmol-1,则该晶胞中含有的P4分子数为___________,该晶体的密度为___________g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com