
下列图与对应的叙述相符的是
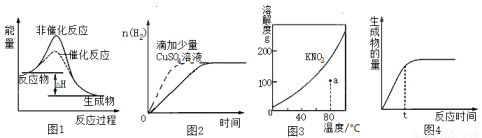
A.图1 表示某吸热反应分别在有、无催化剂时,反应过程中的能量变化
B.图2表示常温下,等量锌粉与足量、等浓度盐酸反应(滴加CuSO4溶液的为虚线)
C.图3表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
乙醇、乙二醇、丙三醇中分别加入足量金属钠,产生等体积的氢气(相同条件下),则上述三种醇的物质的量之比是( )
A.3:2:1 B.1:1:1 C. 1:2:3 D.6:3:2
查看答案和解析>>
科目:高中化学 来源:2016届吉林省吉林市高三第三次调研理综化学试卷(解析版) 题型:选择题
下列有关物质应用的说法正确的是
A.烧碱可做食品干燥剂 B.经常接触铅笔芯易造成铅中毒
C.盐类都可以用作调味品 D.蚕丝的主要成分是蛋白质
查看答案和解析>>
科目:高中化学 来源:2016届四川省邛崃市高三强化训练一化学试卷(解析版) 题型:选择题
常温下,下列溶液中各微粒浓度关系或pH判定不正确的是
A.将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2
B.某物质的溶液中由水电离的c(H+) = 1×10-a mol/L,若a>7,则pH一定为14-a
C.pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液,c(Na+)大小关系:①>③>②
D.CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+) + c(H+) = c(CH3COO-) + c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016届天津市河东区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
在印染工业中,连二亚硫酸钠(Na2S2O4)因能使染好的布褪色,而使布能重新染色,故而俗称保险粉,其可溶于水,但不溶于甲醇。工业制备流程如下:

请回答下列问题:
(1)流程①步骤中需在耐高温的坩埚中进行,常用来制做耐高温坩埚的金属氧化物化学式为 。
(2)由锌块制备锌粉的目的是 ;向锌液中鼓入M气体,使液态锌雾化,冷却得到粒度约为180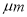 的锌粉。鼓入气体M为常见的化合物,则M的化学式为 ;分散系A为 (填“溶液”“胶体”或“悬浊液”)。
的锌粉。鼓入气体M为常见的化合物,则M的化学式为 ;分散系A为 (填“溶液”“胶体”或“悬浊液”)。
(3)流程②步骤中的化学方程式为 。
(4)流程③的分离方法步骤为 、洗涤、干燥,洗涤所用试剂是 ;过滤前加入NaCl固体的作用是 。
(5)将等体积0.04 mo1·L-1AgNO3溶液和0.02 mol·L-1碱性Na2S2O4溶液混合,两者恰好完全
反应,反应后溶液中有纳米级的银粉生成,写出反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届四川省宜宾县高三第一次适应性测试理综化学试卷(解析版) 题型:实验题
W结构中含有三个六元环,是一种新型香料的主要成分之一。W的合成路线如下(部分产物和部分反应条件略去):
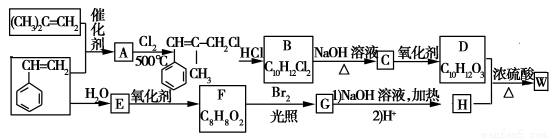
已知:①RCH===CH2+CH2===CHR′CH2===CH2+RCH===CHR′
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子
③D和H是同系物
请回答下列问题:
(1)G分子中含有的官能团名称是 。
(2)A→B反应过程中涉及的反应类型有 、 。
(3)W的结构简式为 。
(4)B→C的化学方程式为 ;由D生成高分子化合物的方程式为 。[
(5)同时满足下列条件的F的同分异构体有 种(不包括立体异构):
①能发生银镜反应;②能发生水解反应。
其中核磁共振氢谱为5组峰的为 (写结构简式),其峰面积之比为 。
查看答案和解析>>
科目:高中化学 来源:2016届四川省宜宾县高三第一次适应性测试理综化学试卷(解析版) 题型:选择题
二氧化锰是常用的催化剂、氧化剂和活性电极材料。海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
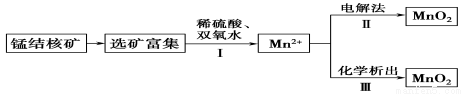
已知:反应Ⅱ以石墨为电极,电解硫酸锰溶液制二氧化锰;反应Ⅲ可以是高锰酸钾氧化硫酸锰,也可以是氯酸钾氧化硫酸锰。下列推断不正确的是( )
A.反应Ⅰ的离子方程式为MnO2+H2O2+2H+===Mn2++2H2O+O2↑
B.反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O===MnO2↓+4H+
C.若加入KClO3,则反应Ⅲ为2ClO+5Mn2++4H2O===5MnO2↓+Cl2↑+8H+
D.若加入KMnO4,则反应Ⅲ为3Mn2++2MnO+2H2O===5MnO2↓+4H+
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三4月质检理综化学试卷(解析版) 题型:填空题
硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
②1/4CaSO4(s)+CO(g) 1/4CaS(s)+CO2(g) △H = - 47.3kJ•mol-1
1/4CaS(s)+CO2(g) △H = - 47.3kJ•mol-1
反应CaO(s)+3CO(g)+SO2(g)  CaS(s)+3CO2(g) △H= kJ•mol-1;
CaS(s)+3CO2(g) △H= kJ•mol-1;
平衡常数K的表达式为 。
(2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。

图1中压强p1、p2、p3的大小顺序为 ,理由是 ;该反应平衡常数的大小关系为K(T1) K(T2) (填“>”、“<”或“=”),理由是 。
(3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是 。
②据图2判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三下学期考前练习化学试卷(解析版) 题型:填空题
氢能是一种极具发展潜力的清洁能源,硫碘循环制氢主要的热化学方程式为:
Ⅰ.SO2(g)+2H2O(l)+I2(g)=H2SO4 (l)+2HI(g) △H=35.9 kJ/mol
Ⅱ.2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) △H=470kJ/mol
Ⅲ.2HI(g)=H2(g)+I2(g) △H=14.9kJ/mol
(1)反应2H2(g)+ O2(g)=2H2O(l)的△H= mol·L-1。
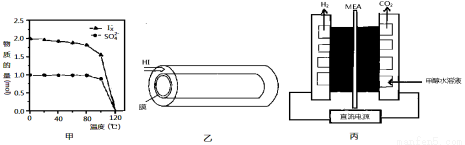
(2)反应Ⅰ在液相中发生称为bensun反应,向水中加入1mol SO2和3mol I2,在不同温度下恰好完全反应生成的n(SO42-)和n(Ix-)的变化见图甲。
①Ix-中x= 。②温度达到120℃时,该反应不发生的原因是 。
(3)反应Ⅲ是在图乙中进行,其中的高分子膜只允许产物通过,高分子膜能使反应程度 ___ (填“增大”、“减小”或“不变”),在该装置中为了进一步增大达平衡时HI的分解率;不考虑温度的影响,还可以采取的措施为 。
(4)图丙是一种制备H2的方法,装置中的MEA为允许质子通过的电解质膜。
①写出阳极电极的反应式: 。
②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com