
 .
. 分析 由甲、乙能使溴水褪色,甲分子中所有原子共平面,但乙分子不是所有原子共平面,可知甲为CH2═CH2,乙为CH3-CH═CH2;
结合丙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色及丁既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色,但在一定条件下可与液溴发生取代反应.一定条件下,1mol丁可以和3mol H2完全加成,则丁为苯,则丙为甲烷,以此来解答.
解答 解:由上述分析可知,甲为CH2═CH2,乙为CH3-CH═CH2,丙为甲烷,丁为苯,
(1)甲的结构简式为CH2═CH2,丙的空间构型是正四面体,故答案为:CH2═CH2;正四面体;
(2)丁为苯,与H2在催化剂作用下发生加成反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质为解答该题的关键,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取某盐溶液进行焰色反应,火焰呈黄色,说明该盐溶液含钠元素,一定不含钾元素 | |
| B. | 用小刀切下一小块金属钠,将剩余的钠再放回原试剂瓶 | |
| C. | 向某溶液中加入BaCl2溶液产生白色沉淀,再加稀盐酸沉淀不溶解,说明原溶液中一定含有SO42- | |
| D. | 向沸水中逐滴滴加1mol•L-1FeCl3溶液,并不断用玻璃棒搅拌,可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食物溶于水后的溶液中pH<7,则为成酸性食物 | |
| B. | 由碳、氮、硫、磷等元素组成的蛋白质多是酸性食物;蔬菜、水果多是碱性食物 | |
| C. | 大米是碱性食物 | |
| D. | 柠檬是酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①表示可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0 | |
| B. | 图②表示用惰性电极电解足量氯化钠溶液.一段时间后,两极上可收集到相等体积的气体 | |
| C. | 图③表示可逆反应:A2(g)+3B2(g)?2AB3(g)△H<0 | |
| D. | 图④表示压强对可逆反应2A(g)+B(g)?3C(g)+D(s)的影响,乙压强大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加H2的浓度,可提高CO2转化率 | |
| B. | 升高温度,可提高CO2转化率 | |
| C. | 升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动 | |
| D. | 改用高效催化剂,可增大反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
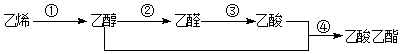
| A. | ①反应:CH2=CH2+H2O $\stackrel{催化剂}{→}$ CH3CH2OH取代反应 | |
| B. | ②反应:CH3CH2OH+O2$→_{△}^{Cu}$ CH3CHO+H2O氧化反应 | |
| C. | ③反应:2 CH3CHO+O2$\stackrel{催化剂}{→}$ 2CH3COOH氧化反应 | |
| D. | ④反应:CH3COOH+C2H5OH $→_{△}^{浓硫酸}$ CH3COOC2H5加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com