
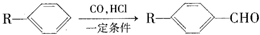
 为合成某种液晶材料的中间体M,有人提出如下不同的合成路径:
为合成某种液晶材料的中间体M,有人提出如下不同的合成路径: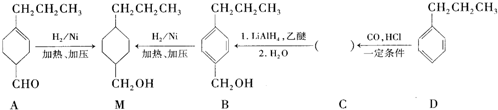
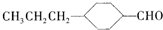 和
和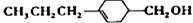 (写结构简式)生成.
(写结构简式)生成.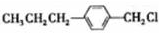 .
. .
. 分析 由合成流程可知,A→M发生-CHO和C=C的加成反应,B→M为苯环的加成反应,结合信息可知,D→C发生取代反应,C为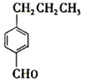 ,名称为对丙基苯甲醛,C→B为-CHO的加成反应,然后结合有机物的结构与性质来解答.
,名称为对丙基苯甲醛,C→B为-CHO的加成反应,然后结合有机物的结构与性质来解答.
解答 解:由合成流程可知,A→M发生-CHO和C=C的加成反应,B→M为苯环的加成反应,结合信息可知,D→C发生取代反应,C为 ,名称为对丙基苯甲醛,C→B为-CHO的加成反应,
,名称为对丙基苯甲醛,C→B为-CHO的加成反应,
(1)A分子中含C=C,能与溴水发生加成反应,且C=C、-CHO均能被酸性高锰酸钾氧化,而苯、乙酸乙酯不与A反应,所以能够与A反应的为bd,
故答案为:b、d;
(2)M含有羟基,C为 ,比较C和B的结构可知,由C→B反应类型为加成反应,也为还原反应,
,比较C和B的结构可知,由C→B反应类型为加成反应,也为还原反应,
故答案为:羟基;加成反应(或还原反应);
(3)由A催化加氢生成M的过程中,C=C、-CHO均能与氢气发生加成反应,则生成中间体为: 或
或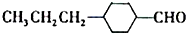 ,
,
故答案为: ;
;
(4)C为CH3CH2CH2C6H4CHO,检验B中是否含有C,科利用醛基的性质选银氨溶液(或新制氢氧化铜悬浊液)产生银镜(或砖红色沉淀)即可证明,
故答案为:银氨溶液(或新制氢氧化铜悬浊液);
(5)B也可由C10H13Cl与NaOH水溶液共热生成,碳链骨架不变,则C10H13Cl的结构简式为: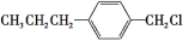 ,
,
故答案为: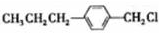 ;
;
(6)C为CH3CH2CH2C6H4CHO,其同分异构体E具有如下特点:a.分子中含-OCH2CH3、b.苯环上只有两种化学环境不同的氢原子,则另一取代基为乙烯基,二者为对位的位置,苯环上只有两种H,则E的结构简式为 ,发生加聚反应的方程式为
,发生加聚反应的方程式为 ,
,
故答案为: .
.
点评 本题考查有机合成,为高考常见题型,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,注意明确有机反应概念及反应类型的判断方法,试题侧重考查学生的分析、理解能力及逻辑推理能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,44gCO2含有NA个C原子 | |
| B. | 1 L0.1mol•L-1Na2S溶液中含有0.1NA个S2- | |
| C. | 0.1mol Na与足量O2反应,转移0.2NA个电子 | |
| D. | 标准状况下,22.4L的CCl4含有4NA个Cl原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.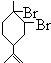 、
、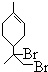 .(用键线式表示)
.(用键线式表示)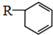 (R代表烃基),可能的结构共有4种.
(R代表烃基),可能的结构共有4种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ②④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7 | B. | 6 | C. | 5 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com